Химия - это наука о строении вещества, его свойствах и превращениях. Одним из основных понятий в химии являются структурные единицы, такие как атомы и молекулы.
Атомы представляют собой наименьшие частицы вещества, которые обладают химическими свойствами элементов. Они состоят из электронов, протонов и нейтронов, которые образуют ядро атома и облако электронов вокруг него.
Когда атомы объединяются на определенном уровне, они образуют молекулы. Молекулы являются структурными единицами вещества, которые могут быть представлены различными соединениями и обладать своими уникальными свойствами.
Структурные единицы в химии:
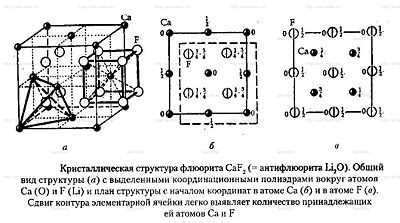
Молекулы – совокупность атомов, связанных между собой химическими связями. Молекулы могут быть простыми, состоящими из одного типа атомов, или сложными, где в состав входят различные элементы.
Атомы и их строение
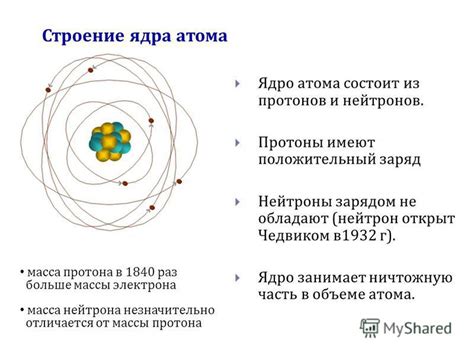
Строение атома определяется числом протонов в ядре, что определяет его атомный номер, и числом нейтронов, что определяет его массовое число. Электроны находятся в области вокруг ядра, создавая электронные оболочки, каждая из которых может содержать определенное количество электронов.
Химические валентности атомов
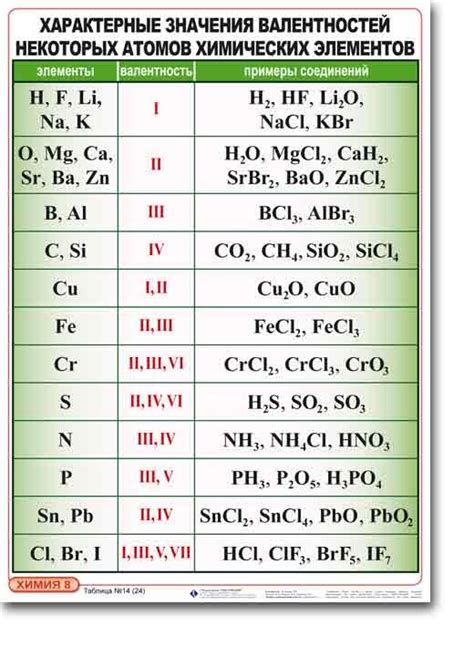
Химическая валентность атома определяет количество связей, которые он может образовать с другими атомами при образовании химических соединений. Валентность атома зависит от числа валентных электронов на его внешней оболочке.
Например, кислород имеет валентность 2, так как на его внешней оболочке находится 6 электронов, а максимально может быть 8.
Каждый химический элемент имеет определенную валентность, что позволяет предсказывать его химические свойства и способность к образованию соединений.
| Элемент | Валентность |
|---|---|
| Водород | 1 |
| Кислород | 2 |
| Углерод | 4 |
| Азот | 3 |
Молекула: определение и свойства
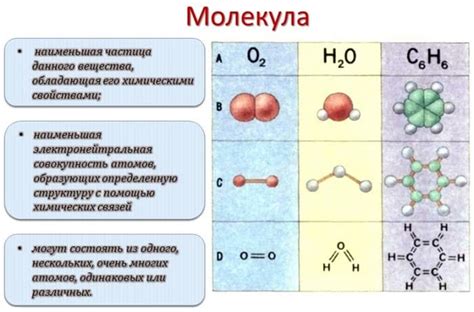
Молекулы могут быть составлены из однотипных или различных атомов, образуя соответственно простые и сложные вещества. Структура молекулы определяет ее свойства: форму, размеры, способы взаимодействия с другими молекулами и веществами.
Обратите внимание, что молекулы могут быть как нейтральными, так и заряженными. Кроме того, молекулы различаются по сложности и размеру: от простых двухатомных молекул до сложных полимеров, состоящих из множества атомов.
Химические связи в молекулах
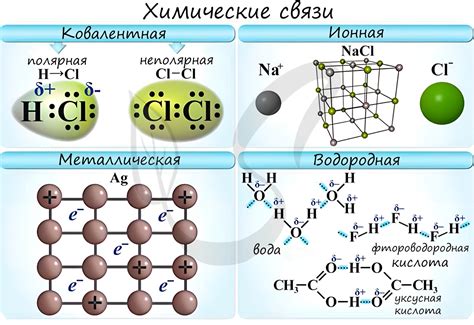
Ионная связь возникает между атомами с разной электронной окраской, что приводит к образованию ионов со заряженными частицами. Примером ионной связи является образование хлорида натрия (NaCl).
Ковалентная связь основана на общем использовании электронов между атомами. Атомы обменивают пары электронов, образуя молекулу. Примерами ковалентных связей являются молекулы воды (H2O) и диоксида углерода (CO2).
Металлическая связь характеризуется тем, что свободные электроны перемещаются между атомами металла, образуя электронное облако. Это обеспечивает возможность проводить ток. Примером металлической связи является структура металлических кристаллов.
Ионные и ковалентные соединения

Ковалентные соединения образуются за счет общих электронных пар между атомами. В ковалентных соединениях атомы делят электроны, чтобы достичь стабильного состояния. Примерами ковалентных соединений являются H2O (вода) и CO2 (углекислота).
Полярность молекул и их взаимодействие
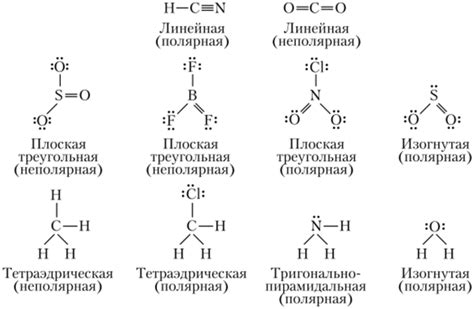
Полярность молекул играет важную роль в химических реакциях и взаимодействиях. Полярные молекулы имеют разделенные положительный и отрицательный заряды, что обусловлено неравномерным распределением электронов в молекуле.
Полярные молекулы могут притягиваться друг к другу силами ван-дер-Ваальса, дипольными силами или водородными связями. Эти взаимодействия могут играть решающую роль в формировании структуры молекул, их свойств и способности к реакциям.
Полярность молекул зависит от разности электроотрицательностей атомов в молекуле. Чем больше эта разность, тем более полярной будет молекула. Например, молекула воды (H2O) является полярной из-за неравномерного распределения электронов между атомами кислорода и водорода.
Важно понимать, что полярность молекул играет ключевую роль в химических свойствах веществ и их поведении в различных средах.
Химические реакции на уровне атомов и молекул

Во время реакций нарушается структура исходных молекул, атомы переформировываются и образуют новые связи. Эти переформирования происходят в соответствии с принципами сохранения массы и заряда.
- Ионная реакция: при обмене ионами образуются новые соединения;
- Кислородно-редукционная реакция: происходит переход электронов между веществами;
- Аддиционная реакция: молекулы соединяются без разрушения своей структуры;
Химические реакции на уровне атомов и молекул – это основа химии и позволяют понять процессы превращения веществ в различных условиях.
Вопрос-ответ

Что такое атом в химии?
Атом – это минимальная единица вещества, которая сохраняет химические свойства элемента. Он состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, где располагаются электроны.
Какие функции выполняют молекулы в химии?
Молекулы являются основными строительными блоками вещества и участвуют в химических реакциях. Они могут образовывать связи с другими молекулами, образуя различные соединения и соединительные элементы вещества. Кроме того, молекулы передают информацию о строении и свойствах вещества.



