Галогены - это группа химических элементов, которые включают фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Эти элементы относятся к семейству VII группы периодической таблицы и обладают рядом уникальных свойств, которые делают их важными объектами изучения в химии.
Основные характеристики галогенов: они обладают высокой электроотрицательностью, что делает их сильными окислителями; галогены имеют низкие температуры плавления и кипения, что позволяет им существовать в разных агрегатных состояниях; химические соединения галогенов часто проявляют характеристики кислотности и токсичности.
В данной статье мы рассмотрим основные свойства галогенов, их взаимодействие с другими элементами, области применения в промышленности и жизни, а также значимость для понимания химических процессов.
Что такое галогены в химии?

- Фтор (F) - самый активный из галогенов, используется в производстве различных химических соединений, зубных паст и материалов с высокой термической стабильностью.
- Хлор (Cl) - широко используется в производстве пластмасс, химических реакций и для очистки воды.
- Бром (Br) - применяется в фармацевтике, сельском хозяйстве и для производства огнезащитных материалов.
- Иод (I) - необходим для нормального функционирования щитовидной железы и применяется в медицине, а также для дезинфекции.
Основные свойства химических элементов
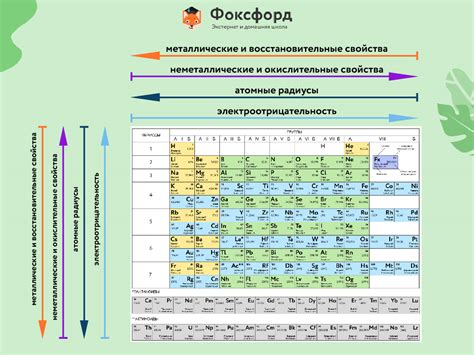
Галогены относятся к группе химических элементов, которые находятся в группе 17 периодической таблицы, включая фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At).
1. Электроотрицательность: Галогены обладают высокой электроотрицательностью, что делает их хорошими окислителями.
2. Физическое состояние: При нормальных условиях фтор и хлор - газы, бром - жидкость, а иод и астат - твердые вещества.
3. Цвет и запах: Галогены имеют характерные цвета и запахи; фтор - желтый газ без запаха, хлор - зеленовато-желтый сильно пахнущий газ, бром - красно-коричневая жидкость с резким запахом, иод - фиолетовое твердое вещество с запахом йода, астат - черное твердое вещество с металлическим блеском.
Реактивность галогенов и их химическое поведение
Галогены (фтор, хлор, бром, йод) обладают высокой реактивностью из-за того, что у них неполные внешние электронные оболочки. Они стремятся завершить эти оболочки, образуя галогениды с другими элементами.
Фтор – самый реактивный галоген. Он способен замещать другие галогены из их соединений, образуя более стабильные соединения. Фтор сильно окисляет большинство элементов.
Хлор также обладает высокой реактивностью. Он часто используется в химических реакциях и процессах, таких как хлорирование органических соединений.
Бром менее реактивен, чем фтор и хлор, но все равно обладает способностью проводить химические реакции. Он может вступать в аддиционные реакции, образуя бромиды с различными соединениями.
Йод является наименее реактивным из галогенов. Он может проявлять свою химическую активность в присутствии катализаторов или в условиях повышенной температуры.
Общее химическое поведение галогенов связано с их способностью к образованию соединений с другими элементами и аддиционными реакциями. Изучение реактивности галогенов позволяет понять их химическое поведение и применение в различных процессах и реакциях.
Важные соединения галогенов и их применение

Галогены образуют множество важных соединений, которые находят применение в различных областях химии и промышленности. Например, хлорид натрия (NaCl) или кухонная соль широко используется в пищевой промышленности, медицине, а также для соления и консервирования продуктов. Бромиды и йодиды применяются в фотографии как чувствительные вещества для пленки и фотобумаги. Фториды используются в производстве стекла и керамики, а также в дентальной практике для профилактики кариеса.
Источники галогенов и значение в жизни

Галогены играют значительную роль в жизни организмов. Например, йод является важным микроэлементом для щитовидной железы, а хлор в форме ионов участвует в балансе воды в организме. Фтор используется в стоматологии для профилактики зубных заболеваний. Таким образом, галогены имеют значительное значение для поддержания здоровья человека и животных.
Вопрос-ответ

Что такое галогены в химии?
Галогены - это группа элементов, которая включает в себя фтор, хлор, бром, йод и астат. Они относятся к 17 группе периодической системы химических элементов. Галогены имеют характерные химические свойства, такие как высокая реакционность, способность к образованию солей и кислот. Они являются важными компонентами многих органических и неорганических соединений.
Какие основные свойства галогенов выделяются в химии?
Основные свойства галогенов включают высокую реакционность, способность к образованию соединений с металлами, создание солей и кислот, а также широкое применение в различных отраслях химии. Галогены обладают различными окрасками, например, фтор - безцветный газ, хлор - желтовато-зеленый газ, бром - красноватый жидкий элемент, йод - блестящие чешуйки, астат - радиоактивный элемент.
Какие химические реакции характерны для галогенов в химии?
Галогены проявляют высокую реакционность и образуют разнообразные химические соединения. Например, реакция галогенов с металлами приводит к образованию солей, так называемых галогенидов. Также галогены способны образовывать кислоты, амиды, оксиды и другие соединения. Интересно, что галогены могут образовывать межгалогенные соединения, например, хлорид йода. В целом, галогены участвуют в множестве важных химических реакций.



