Ионная связь – один из основных типов химической связи, который возникает между ионами разных зарядов. Важным аспектом ионной связи является ее направленность, которая определяется не только электростатическими взаимодействиями между ионами, но и геометрической структурой кристаллической решетки.
Направленность ионной связи играет ключевую роль в формировании структуры кристалла и влияет на его физические и химические свойства. Зависит от расстояния между ионами, а также от их радиусов и зарядов. Межатомные расстояния в кристалле определяются величиной ионного радиуса, что влияет на углы и направления ионных связей.
Насыщаемость ионной связи также важна для понимания ее характеристик. Насыщенность ионной связи определяется количеством ионных связей, участвующих в структуре кристалла. Этот параметр влияет на устойчивость структуры и твердость кристаллического вещества.
Важность ионной связи
Основные понятия
Катион - ион с положительным зарядом, обычно образуется металлами.
Анион - ион с отрицательным зарядом, обычно образуется неметаллами.
Электростатическое притяжение - сила притяжения между положительно и отрицательно заряженными ионами.
Кристаллическая решетка - трехмерная структура, в которой ионы упорядочены в определенном порядке.
Механизм образования ионной связи
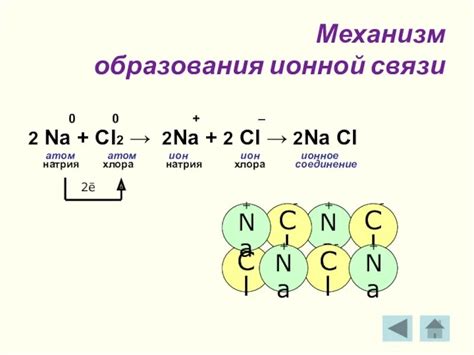
Ионная связь образуется между атомами, которые обладают различной электроотрицательностью. Как правило, один атом обладает значительно большей электроотрицательностью, чем другой, что приводит к образованию ионообразной связи.
При образовании ионной связи один атом отдаёт один или несколько электронов другому атому, образуя положительный ионы катион и отрицательный ионы анион. Получившаяся электростатическая привлекательная сила между ионами и образует ионную связь.
Важно отметить, что ионная связь обладает направленностью и насыщаемостью. Это связано с тем, что ионы окружаются сфером поля, и направление их ориентации определяется в кристаллической решетке ионного кристалла.
Электронный обмен

Электронегативность элементов

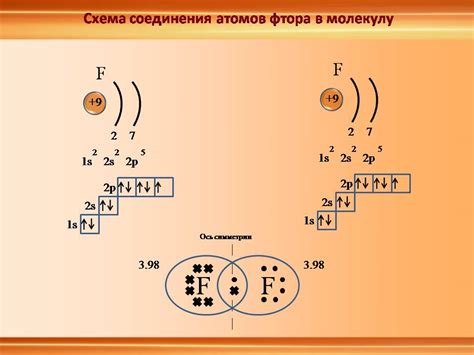
Наибольшая электронегативность присуща флуору, имеющему наибольший электронный аффинитет и наибольшую силу атомного радиуса. Наоборот, щелочные металлы (например, натрий, калий) имеют низкую электронегативность из-за большого атомного радиуса и низкой энергии ионации.
Электронегативность важна для понимания химических связей, так как элементы с разными электронегативностями могут образовывать различные типы связей, например, ионные, ковалентные или металлические, в зависимости от разницы в их электронегативностях.
Кристаллическая структура
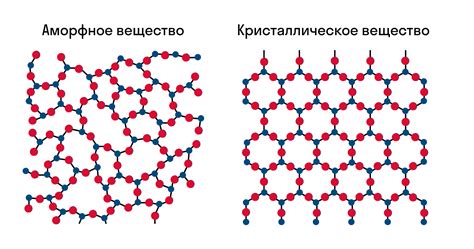
Ионная связь играет решающую роль в формировании кристаллической структуры веществ, обладающих ионными связями. В ионных кристаллах ионы упорядочены в трехмерной структуре, где каждый ион окружен сферично соседними ионами, образуя кристаллическую решетку. Такая структура обеспечивает высокую устойчивость кристалла и позволяет ему обладать определенными физико-химическими свойствами.
Кристаллическая структура ионных соединений может быть описана через координационное число, а также через тип упаковки ионов в решетке (телоцентрическая, кубическая, гексагональная и т.д.). Ионные кристаллы характеризуются высокой степенью симметрии и ригидной структурой, что обуславливает их кристаллическую упорядоченность и характерные формы кристаллов.
Особенности ионной связи
Ионная связь характеризуется направленностью взаимодействия между ионами разных зарядов за счет притяжения положительных и отрицательных зарядов.
Основной особенностью ионной связи является обмен электронами между ионами, что приводит к образованию ионов.
Ионная связь характеризуется высокой насыщаемостью. Соединения обладают кристаллической структурой, где ионы занимают фиксированные положения в решетке.
Слабые электростатические силы, которые действуют между ионами, определяют устойчивость и силу ионных связей в веществе.
Полярность соединений
Полярность соединений играет важную роль во взаимодействии ионов в ионной связи. Соединения, в которых разность электроотрицательности между атомами большая, считаются полярными. В таких соединениях электроны проводимости смещены в сторону более электроотрицательного атома, создавая положительный и отрицательный полюса. Это способствует более сильному притяжению между ионами и обуславливает насыщенность и направленность ионной связи.
Реакции в растворе
Ионы в растворе играют ключевую роль в химических реакциях. Когда ионы соединения растворяются в воде, они отделяются друг от друга и свободно перемещаются в растворе.
Благодаря этому свойству, ионы могут взаимодействовать между собой, образуя новые соединения. Например, при взаимодействии катиона и аниона в растворе образуется ионная связь, что приводит к образованию нейтрального соединения.
Реакции в растворе могут происходить быстро и эффективно благодаря свободному движению ионов. Это является основой многих химических процессов, происходящих в водных средах.
Применение в жизни

Вопрос-ответ

Чем отличается ионная связь от ковалентной?
Ионная связь образуется между атомами, когда один атом отдаёт электроны другому, образуя положительный и отрицательный ионы, которые притягиваются друг к другу. В ковалентной связи атомы обмениваются парами электронов, и их оболочки перекрываются, что создаёт более сильное взаимодействие.
Как влияет насыщенность окружения ионов на прочность ионной связи?
Чем больше окружающих ионов окружают ион в кристаллической решётке, тем более насыщенным считается его окружение. Насыщенное окружение способствует укреплению ионной связи, так как ослабляет репульсию между заряженными ионами, повышая прочность связи.