Сопряженная кислота и основание - это понятия из химии, которые описывают пары веществ, участвующих в реакциях протонов. Когда кислота отдаёт протон, она образует связанное с ней основание, которое в свою очередь может принять протон обратно, возвращаясь к форме кислоты. Таким образом, кислота и сопряженное с ней основание образуют сопряженную пару.
Примеры сопряженных пар: хлорноводород (HCl) и хлористый ион (Cl^-), аммиак (NH3) и аммоний (NH4^+). Когда HCl отдаёт протон, образуется Cl^-, который в этом случае является сопряженным основанием кислоты HCl. Такие сопряженные пары играют важную роль в химических реакциях и в поддержании кислотно-основного равновесия в растворах.
Сопряженная кислота и основание: определение и роль
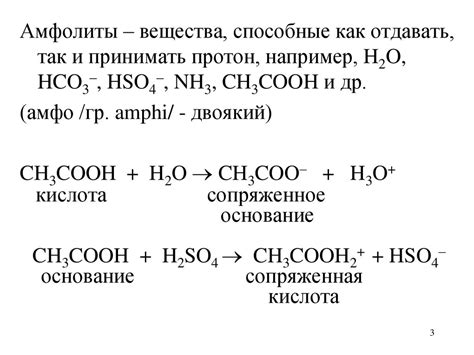
Как образуются сопряженные кислоты и основания?

Сопряженные кислоты и основания образуются в результате протекания химических реакций между кислотами и основаниями. Когда кислота донорно отдаёт протон (H+) и образует конъюгированную основу, то эта конъюгированная основа становится сопряженным основанием для данной кислоты. То же самое происходит и с основаниями, которые могут донорно принять протон и образовать сопряженную кислоту.
| Кислота | Сопряженная кислота |
|---|---|
| HCl | Cl- |
| H2SO4 | HSO4- |
Таким образом, сопряженные кислоты и основания образуются в результате взаимодействия друг с другом и играют важную роль в химических реакциях.
Примеры в химии

Рассмотрим несколько примеров сопряженных кислот и оснований в химии:
Пример 1: Кислота HCl (хлороводородная) и ее сопряженное основание Cl- (хлорид) образуют сопряженную пару. HCl действует как кислота, а Cl- как основание.
Пример 2: Кислота H2CO3 (угольная) и ее сопряженное основание HCO3- (бикарбонат) также образуют сопряженную пару. H2CO3 может действовать как кислота, а HCO3- как основание.
Пример 3: Кислота H2O (вода) и ее сопряженное основание OH- (гидроксид) - еще один пример сопряженной пары. H2O может действовать как кислота или основание, в то время как OH- - как основание.
Реакция с водой
Сопряженные кислоты и основания могут реагировать с водой, образуя ион водорода (H+) или гидроксидный ион (OH-). Например, рассмотрим реакцию между сопряженной кислотой аммония (NH4) и водой:
- NH4+ + H2O → NH3 + H3O+
В данном случае NH4+ действует как кислота, отдавая протон воде и образуя аммиак (NH3). В результате образуется ион гидрония (H3O+), который является сопряженной кислотой. Таким образом, вода может служить основанием в данной реакции.
Связь с pH

Концентрация сопряженной кислоты и основания влияет на pH раствора. pH легко определяется используя уравнение Гендерсона-Хассельбальха:
| Тип реакции | Формула |
|---|---|
| Кислотная | pH = pKa + log([A-]/[HA]) |
| Основная | pOH = pKb + log([B]/[BOH]) |
Где [A-] - концентрация сопряженного основания, [HA] - концентрация сопряженной кислоты, [B] - концентрация основания, [BOH] - концентрация сопряженной кислоты. Изучение сопряженных кислот и оснований позволяет понять как изменения их концентраций сказываются на pH раствора.
Применение в биологии

В биологии концепция сопряженных кислот и оснований играет важную роль в понимании механизмов реакций, происходящих в организме. Например, регуляция pH внутри клеток влияет на активность ферментов, мембранные транспортные процессы и многие другие биологические процессы. Важную роль играют сопряженные кислоты и основания в буферных системах, которые обеспечивают стабильность pH в живых организмах. Они также участвуют в регуляции кислотно-щелочного равновесия крови и других жидкостей организма.
Примером может служить реакция карбоновой кислоты и ее сопряженных баз - бикарбоната (HCO3-) и карбоната (CO32-). Важную роль эта система играет в буферизации крови и регуляции кислотно-щелочного равновесия в организме человека.
| Кислота | Сопряженная база |
|---|---|
| Уксусная кислота (CH3COOH) | Ацетатный ион (CH3COO-) |
| Фосфорная кислота (H3PO4) | Дигидрофосфатный ион (H2PO4-) |
Вопрос-ответ

Что такое сопряженная кислота и основание?
Сопряженные кислота и основание - это пары веществ, которые отличаются на один протон. Сопряженная кислота образуется, когда кислота отдает протон, а сопряженное основание образуется, когда основание принимает протон.
Какие примеры сопряженных кислот и оснований можно привести?
Примером сопряженной кислоты и основания может служить вода и ее сопряженные формы: H2O (вода) и OH- (гидроксид ион) - это сопряженная кислота и основание. Также можно привести пример аммония (NH3) и его сопряженные формы NH4+ (аммоний) - это сопряженная кислота и основание.
В чем отличие между сопряженными кислотами и основаниями?
Сопряженная кислота имеет на один протон больше, чем соответствующее ей сопряженное основание. Сопряженные кислота и основание образуются при обмене протонами и обладают слабой кислотно-основной активностью.
Как происходит образование сопряженных кислот и оснований?
Сопряженные кислота и основание образуются в результате протонной передачи. Когда кислота отдает протон, то образуется сопряженная основание, а если основание принимает протон, то образуется сопряженная кислота.
Зачем важно понимать концепцию сопряженных кислот и оснований?
Понимание сопряженных кислот и оснований важно для понимания химических реакций, в том числе для понимания кислотно-основных реакций. Это позволяет предсказывать направление химических реакций и определить, какое вещество будет действовать как кислота или основание в конкретной системе.



