Давайте представим себе картину: вы общаетесь с одним экспертом, который утверждает, что вода может вызывать неожиданные реакции при взаимодействии с оксидами. Затем вы слышите другое мнение от кого-то другого, кто утверждает, что подобные реакции просто невозможны. Возникает вопрос: в ком из них можно доверять? Как определить, что правда, а что вымысел?
В данной статье мы попытаемся разобраться в этом вопросе. Мы исследуем научные факты, изучим эксперименты, проведенные учеными в этой области а также рассмотрим различные точки зрения, чтобы составить полную картину. Мы будем использовать надежные источники информации, чтобы приблизиться к истине и понять, действительно ли вода и основные оксиды создают яркие и химические реакции при контакте друг с другом.
Прежде чем мы начнем наше путешествие в мир химии и реакций, давайте разберемся в некоторых основных понятиях, чтобы понять, о чем идет речь. Первое, что стоит отметить, это то, что вода – это жидкость, которую мы используем в повседневной жизни для различных целей. Интересно то, что вода может быть солевой, кислой или щелочной, в зависимости от ее pH-значения. Второе понятие, важное для нашей дискуссии, это оксиды – химические вещества, состоящие из химических элементов, обычно металлов или полуметаллов, соединенных с кислородом. Они придают веществам определенные свойства и могут быть основными или кислыми, в зависимости от их реакции с водой.
Основные оксиды: их роль и свойства
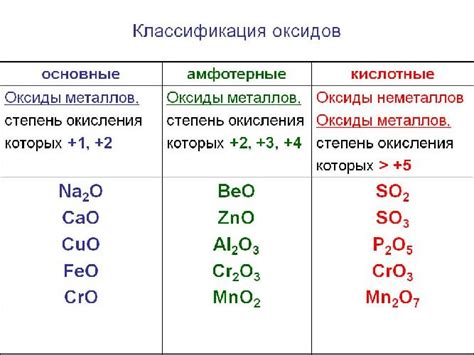
Основные оксиды - это соединения, в состав которых входят оксидирующие элементы. Они способны взаимодействовать с водой и образовывать гидроксиды - основные соединения, обладающие щелочными свойствами. Важно отметить, что взаимодействие с водой происходит не у всех основных оксидов, а только у определенной группы веществ.
Основные оксиды обладают разными свойствами и физическими характеристиками. Некоторые из них являются твердыми веществами, другие - газами или жидкостями. Важным фактором, влияющим на их свойства, является соединенный элемент, а также его окислительность и электроотрицательность.
Основные оксиды обычно используются в промышленности и научных исследованиях. Их применение обусловлено их присутствием в составе различных соединений, необходимых для производства различных товаров. Они находят применение в производстве стекла, глины, удобрений и других химических веществ.
Основные оксиды - это группа веществ, которые обладают способностью взаимодействовать с водой и образовывать гидроксиды. Эти вещества имеют разные свойства в зависимости от состава и структуры. Они широко используются в различных отраслях промышленности и науки.
Активность основных оксидов в процессе их взаимодействия с водой

В данном разделе рассмотрим активность основных оксидов при контакте с водой и изучим, какие изменения происходят в результате таких реакций.
Для начала, обратим внимание на способность основных оксидов проявлять активность при соприкосновении с водой. Основные оксиды, также известные как основания, являются соединениями, которые обладают сильными щелочными свойствами и способны реагировать с кислотами. Когда основный оксид вступает в реакцию с водой, происходит образование соответствующих гидроксидов, что является одним из наиболее распространенных способов образования щелочей.
Активность основных оксидов во время реакции с водой зависит от их способности отдавать отрицательно заряженные оксидные ионы и образовывать гидроксиды. Для иллюстрации этого процесса можно привести следующие примеры реакций:
- Оксид кальция (известный также как известняк) в контакте с водой дает гидроксид кальция (известный как известь) и высвобождает значительное количество тепла.
- Оксид натрия (известный также как сода) при соединении с водой образует гидроксид натрия (известный как щелочь) и также выделяет большое количество тепла.
Что влияет на скорость процесса реагирования?

Среда играет значительную роль в скорости реакций. Вода или другие растворы, в которых происходят реакции, могут оказывать влияние на активность молекул и различные функциональные группы, что в свою очередь может ускорять или замедлять их взаимодействия. Понимание влияния среды позволяет нам оптимизировать условия реакции для достижения нужных результатов.
Температура также является важным фактором, определяющим скорость химических реакций. При повышении температуры увеличивается среднеквадратичная скорость движения молекул, что приводит к более частым столкновениям и, следовательно, более быстрой реакции. Температурный эффект может быть объяснен с помощью кинетической теории.
Концентрация реагентов является еще одним фактором, влияющим на скорость реакции. Чем больше концентрация реагентов, тем больше вероятность столкновения и тем выше скорость реакции. Это связано с тем, что при увеличении концентрации количество реагирующих частиц увеличивается.
Катализаторы могут драматически повысить скорость реакций, участвуя в реакционном механизме и ускоряя его. Катализаторы обычно непревращаются в процессе реакции и могут быть использованы снова и снова для ускорения различных химических превращений.
В заключении, скорость процесса реагирования зависит от различных факторов, таких как среда, температура, концентрация реагентов и присутствие катализаторов. Понимание этих факторов позволяет нам контролировать и управлять химическими реакциями для достижения желаемых результатов.
Основные оксиды и их электролитическая диссоциация
При контакте с водой основные оксиды проявляют способность диссоциировать на ионы, что приводит к образованию гидроксидов. Данный процесс можно назвать электролитической диссоциацией основных оксидов. Электролитическая диссоциация подразумевает разложение вещества на ионы под воздействием воды или другого растворителя.
Ионы гидроксидов, образующиеся при электролитической диссоциации основных оксидов, обладают сильной основностью и способны проявлять щелочные свойства. Это позволяет основным оксидам широко применяться в различных отраслях химии и промышленности.
Основные оксиды и их электролитическая диссоциация имеют важное значение для понимания химических реакций, происходящих с участием данных веществ. Это позволяет более глубоко изучить свойства основных оксидов и их взаимодействие с водой, что является основой для рассмотрения реакций основных оксидов с другими веществами.
Степень щелочности растворов основных оксидов

Степень щелочности определяет, насколько щелочной является среда. Щелочными считаются растворы, содержащие большее количество гидроксидных ионов (OH-) в отношении к гидронийным ионам (H+). Одним из факторов, определяющих степень щелочности раствора, является концентрация OH- и H+ ионов, полученных в результате реакции основного оксида с водой.
Под действием воды основные оксиды претерпевают гидратацию, при которой ионы оксидов (O2-) образуют гидроксидные ионы (OH-). В результате этого процесса изменяется концентрация OH- и H+ ионов в растворе, что влияет на его щелочность.
Степень щелочности растворов основных оксидов может быть оценена по значениям pH. pH-индекс является показателем концентрации гидроксидных и гидронийных ионов в растворе. Низкие значения pH указывают на кислотность раствора, высокие - на его щелочность.
Важно отметить, что каждый основной оксид может обладать своей специфической степенью щелочности, которая зависит от химической природы самого оксида и его способности взаимодействовать с водой.
Примеры взаимодействия основных оксидов и воды

Давайте рассмотрим несколько интересных случаев, когда основные оксиды соприкасаются с водой и происходит химическая реакция. В результате такого взаимодействия образуются новые вещества и происходят изменения в исходных соединениях. Рассмотрим эти примеры подробнее.
| Основной оксид | Пример реакции |
|---|---|
| Калийный оксид | Пример реакции |
| Натриевый оксид | Пример реакции |
| Кальциевый оксид | Пример реакции |
Как видно из таблицы, основные оксиды проявляют свою активность и способность взаимодействовать с водой. Подобные реакции могут иметь различные результаты и приводить к образованию разнообразных соединений. Важно отметить, что такие примеры реакций подтверждают факт существования данных взаимодействий и отрицают предположения о вымышленности их сущности. Подобные реакции открывают двери для дальнейших исследований и понимания химических процессов.
Роль основных оксидов в природных и технических процессах
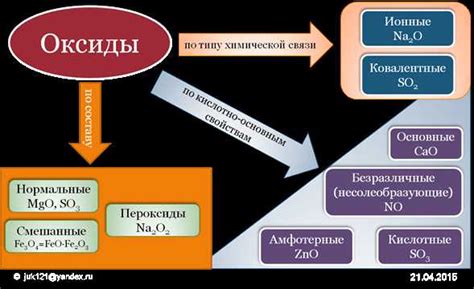
- В природных процессах основные оксиды выполняют роль активных компонентов в геохимических процессах, влияющих на качество почв, воды и атмосферного состава. Они участвуют в процессах минерализации, восстановления и окисления, формируя разнообразные минералы и оттенки почв.
- В технических отраслях основные оксиды находят применение в производстве металлов и сплавов, катализаторах, стекла, керамических материалах, электронных приборах и многих других областях. Они помогают улучшить физико-химические свойства материалов, увеличить их стойкость к воздействию окружающей среды и повысить эффективность процессов.
- Основные оксиды также широко используются в процессах водоочистки, где они способны обеспечить нейтрализацию и осаждение вредных примесей.
- Помимо этого, эти соединения играют важную роль в биохимических реакциях, участвуя в обменных процессах, катализируя различные стадии метаболизма организмов.
Все эти факторы подчеркивают существенное значение основных оксидов в различных процессах природы и человеческой деятельности, что делает изучение их свойств и взаимодействий актуальным и важным направлением химических исследований.
Вопрос-ответ

Что такое основные оксиды?
Основные оксиды - это химические соединения, состоящие из металла и кислорода. Они обладают щелочными свойствами и способны реагировать с водой.
Какие основные оксиды могут реагировать с водой?
Основные оксиды могут реагировать с водой и образовывать основания. Некоторые примеры таких оксидов: оксид натрия (Na2O), оксид калия (K2O), оксид кальция (CaO) и другие.
Как происходит реакция основных оксидов с водой?
Реакция основных оксидов с водой протекает следующим образом: оксид растворяется в воде, образуя гидроксид металла и высвобождая тепло. Например, при реакции оксида натрия с водой образуется гидроксид натрия (NaOH).
Какие результаты может дать реакция основных оксидов с водой?
Реакция основных оксидов с водой приводит к образованию гидроксидов металлов и выделению тепла. Также в процессе реакции может образовываться вспенивание или поглощение воды.
Можно ли использовать реакцию основных оксидов с водой в практических целях?
Да, реакция основных оксидов с водой имеет практическое применение. Например, гидроксиды металлов, образующиеся в результате реакции, являются основаниями и могут использоваться в производстве мыла, стекла и других химических соединений.



