Медь (Cu) - металл, который обладает уникальными химическими свойствами. Однако, в отличие от многих других металлов, медь не реагирует с серной кислотой (H2SO4).
Основная причина отсутствия реакции меди с серной кислотой заключается в том, что медь находится ниже в ряду электродного ряда металлов по сравнению с водородом. Это означает, что водород обладает более высоким потенциалом окисления и может вытеснить медь из ее соединений.
Таким образом, при контакте меди с серной кислотой не происходит реакции, поскольку водород предпочитает образовывать соединения с серной кислотой, а не медь.
Причины отсутствия реакции Cu с H2SO4

Как правило, медь (Cu) не реагирует с серной кислотой (H2SO4) из-за своей низкой электрохимической активности. Когда медь находится в контакте с действующими кислотными растворами, на ее поверхности образуется защитная оксидная пленка, которая предотвращает дальнейшее взаимодействие меди с кислотой.
Эта пленка меди, обычно является хорошим защитным слоем, что способствует сохранению металла от коррозии. Поэтому медь обычно не реагирует с серной кислотой в стандартных условиях.
Электрохимические свойства меди

Электродный потенциал меди равен +0.34 В, что говорит о том, что медь обладает недостатком электронов и может выступать в качестве восстановителя. Поэтому медь активно реагирует с растворами солей серебра или золота, переходя из ионного состояния в металлическое.
Однако медь не реагирует с сильными окислителями, такими как серная кислота H2SO4. Это обусловлено высокой стабильностью медного оксида Cu2O, который образуется на поверхности меди и предотвращает дальнейшее окисление металла.
Таким образом, благодаря своим электрохимическим свойствам, медь широко применяется в электротехнике, строительстве, производстве монет и других сферах промышленности.
Химический состав H2SO4

Формула увеличение глубины знаний о том, почему реакция между медью (Cu) и серной кислотой (H2SO4) не происходит.
Реакционная способность меди
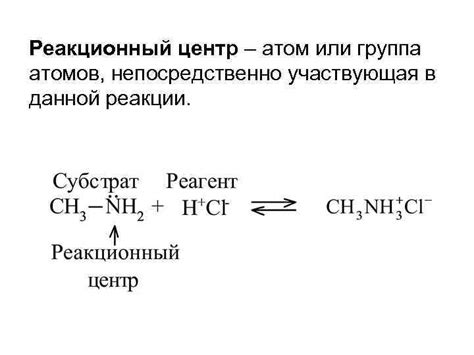
При взаимодействии с H2SO4 медь не проявляет химической активности, поскольку удаление более активного водорода из кислоты не является энергетически выгодным процессом для меди. Вследствие этого, когда медь добавляется в серную кислоту, реакция не происходит, и металл остается неподверженным окислению и разрушению.
| Металл | Взаимодействие с H2SO4 |
|---|---|
| Медь | Не реагирует |
| Цинк | Реагирует, образуя соль и выделяя водород |
| Железо | Реагирует, образуя соль и выделяя водород |
Образование защитной пленки меди
Механизм образования пленки меди заключается в том, что медь взаимодействует с кислородом из воздуха, образуя оксид меди (Cu2O) или гидрооксид меди (Cu(OH)2). Эти соединения образуют тонкую пленку на поверхности меди, которая предотвращает проникновение кислоты к металлу. Таким образом, образование защитной пленки является одной из причин того, почему медь не реагирует с сильными кислотами, включая серную.
Реактивность серы в H₂SO₄

Сера взаимодействует с сильной кислотой H₂SO₄ (серной) только при высоких температурах и специальных условиях. Как правило, это приводит к образованию соединений серы с металлами или другими элементами. Однако, при комнатной температуре сера не реагирует с H₂SO₄. Это объясняется стабильностью элемента и отсутствием достаточно активных активирующих факторов для разрушения молекулы серы и начала реакции. Таким образом, отсутствие реакции серы с H₂SO₄ при комнатной температуре обусловлено ее низкой реактивностью в стандартных условиях.
Факторы, влияющие на химическую реакцию

Химическая реакция между металлом и кислотой зависит от нескольких факторов, которые могут влиять на её протекание. В случае взаимодействия меди (Cu) с серной кислотой (H2SO4), отсутствие реакции может быть обусловлено следующими причинами:
| 1. | Медь (Cu) относится к нобельевским металлам, что делает её устойчивой к реакции с некоторыми кислотами, включая серную кислоту. |
| 2. | У меди (Cu) имеется защитная оксидная пленка на поверхности, которая может препятствовать проникновению кислоты и инициации реакции. |
| 3. | Серная кислота (H2SO4) может не обладать достаточной активностью для окисления меди (Cu) и инициирования реакции. |
Структура меди и ее взаимодействие с кислотой

Медь представляет собой элемент из группы переходных металлов. Она имеет атомный номер 29 и химический символ Cu. В своей элементарной форме медь обычно образует ион Cu2+, который характеризуется высокой тенденцией к окислению.
При взаимодействии меди с серной кислотой (H2SO4), такой реакции не происходит из-за недостижения необходимого потенциала окисления для Cu. Несмотря на то, что медь является достаточно реакционным металлом, ее стабильное соединение с кислотой не образуется.
- Электрохимический потенциал меди не достаточно высок, чтобы реагировать с H2SO4.
- Медь образует защитную пленку оксида или сульфида, которая предотвращает дальнейшее взаимодействие.
- Электрически необходимая реакция Cu с H2SO4 в условиях электролиза или гальванической ячейки является возможной.
Ионный обмен между медью и серой
Не реагирует формированием газа или раствором, но в ходе реакции возможен некоторый ионный обмен между медью и серой. Медь, будучи стабильным металлом, не подвержена разложению в серной кислоте, и может образовывать соединения типа сульфата меди (CuSO4).
| Химическое уравнение: | 4Cu + 2H2SO4 → 2Cu2SO4 + SO2 + 2H2O |
|---|
В результате реакции, медь окисляется до иона меди (II), который образует сульфат меди. Образовавшийся SO2 образует газообразное вещество, а H2O остается в растворе. Однако, реакция меди с серной кислотой не является типичной и не происходит спонтанно из-за относительно низкой активности меди.
Поведение меди в различных условиях кислоты

Однако, при использовании концентрированной серной кислоты, медь может реагировать, образуя соединения меди (II) с выделением диоксида серы и воды.
| Условия | Реакция меди с серной кислотой |
|---|---|
| Разбавленная H2SO4 | Нет реакции, Cu не реагирует. |
| Концентрированная H2SO4 | Медь реагирует, образуя соединения меди (II), SO2 и воду. |
Вопрос-ответ

Почему медь не реагирует с серной кислотой?
Медь не реагирует с серной кислотой в обычных условиях, так как серная кислота не обладает достаточной окислительной силой, чтобы окислить медь до Cu(II) и выйти из реакции в виде SO2 или SO3. Поэтому реакция меди с серной кислотой не происходит.
Каким образом медь реагирует с серной кислотой?
Медь не реагирует с серной кислотой в обычных условиях, но при нагревании сосредоточенной серной кислоты и меди может произойти реакция, в результате которой образуется сульфат меди(II) и диоксид серы. Такая реакция требует высоких температур и характеризуется как экзотермическая.
Могут ли медь и серная кислота реагировать в присутствии катализатора?
В принципе, медь и серная кислота могут реагировать в присутствии подходящего катализатора, который способен обеспечить необходимые условия для окисления меди. Однако стоит помнить, что реакция меди с серной кислотой требует значительных энергетических затрат и специфических условий.
Какие другие кислоты могут реагировать с медью?
Медь может реагировать с различными кислотами, такими как азотная кислота, хлороводородная кислота и другими. В зависимости от условий реакции и концентрации кислоты, могут образовываться различные соединения меди, включая соли и комплексные соединения. Однако реакция меди с серной кислотой в обычных условиях не происходит.
Почему реакция меди с серной кислотой имеет практическое значение?
Реакция меди с серной кислотой, хоть и не происходит при комнатной температуре, но может быть использована в лабораторных условиях для синтеза сульфата меди(II) и диоксида серы. Эти соединения находят свое применение в различных химических процессах и производствах, что делает их важными химическими реакциями.