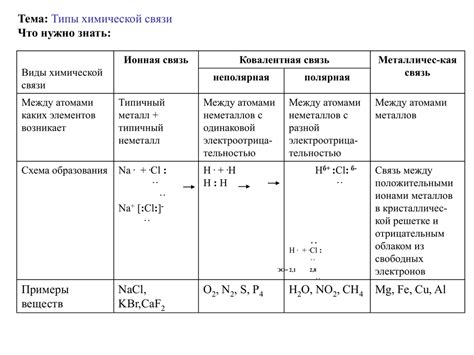
Химические связи – это важное понятие в химии, определяющее структуру и свойства веществ. Существует несколько основных видов химических связей, среди которых наиболее распространены ионная, ковалентная и металлическая связи. Каждый из этих видов связей обладает своими особенностями и характеристиками, определяющими их поведение и химические свойства веществ.
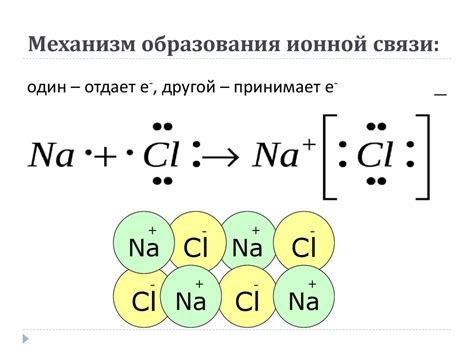
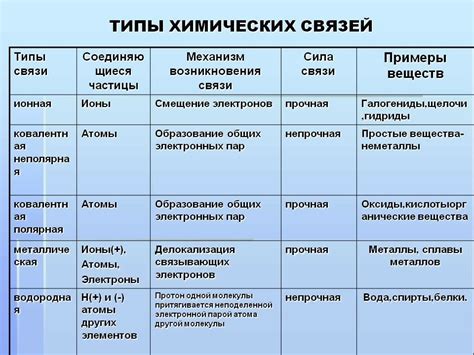
Ионная связь - это тип химической связи, основанный на взаимодействии положительно и отрицательно заряженных ионов. В ионной связи происходит обмен электронами между атомами, образующими ионы различного заряда. Этот тип связи характерен для солей и многих неорганических соединений.
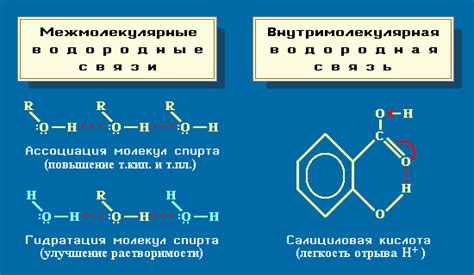
Ковалентная связь - это тип химической связи, основанный на общем использовании электронных пар атомами. В ковалентной связи электроны образуют общий оболочечный облако вокруг атомов, что обеспечивает их устойчивость. Ковалентные связи характерны для органических соединений и многих молекул.
Металлическая связь - это тип химической связи, характерный для металлов. В металлической связи электроны делятся между атомами металла, образуя электронное облако, которое обеспечивает проводимость электричества и тепла. Этот тип связи обуславливает специфические свойства металлов, такие как пластичность и металлический блеск.
Виды химических связей
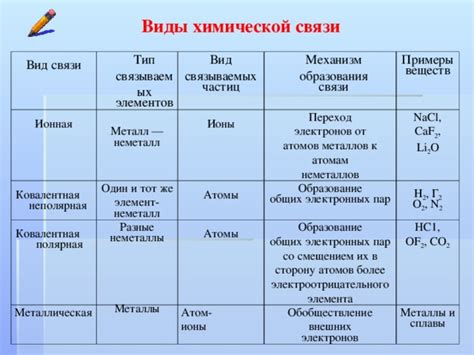
Ионная связь: основана на притяжении положительно и отрицательно заряженных ионов друг к другу. В этом типе связи один атом отдает электрон(ы), образуя положительный ион, а другой атом принимает электрон(ы), становясь отрицательно заряженным ионом.
Ковалентная связь: это связь, в которой атомы в молекуле обменивают электроны, чтобы достигнуть стабильной конфигурации. Общие электроны образуют общую пару, что дает возможность обоим атомам удерживать электроны.
Металлическая связь: характерна для металлических элементов, в которых атомы образуют кристаллическую решетку иионов в кристаллической решетке – катионов, а электроны свободно перемещаются между ними. Это дает металлам характеристику хорошей электропроводности и теплопроводности.
Ионная связь в химии
Ковалентная связь: определение и свойства
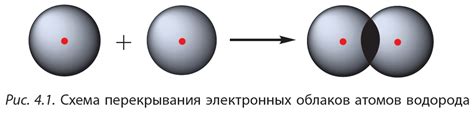
Основные свойства ковалентной связи:
- Она образуется между атомами неметаллов, таких как углерод, кислород, азот.
- Ковалентная связь обычно более прочная, чем ионная связь.
- Энергия ковалентной связи зависит от длины и типа связующих атомов.
- В ковалентной связи электроны делятся между атомами и могут образовывать различные типы связей, например, одинарные, двойные или тройные связи.
Металлическая связь и ее характеристика

Основные характеристики металлической связи:
- Металлическая связь формируется между атомами металла и представляет собой общедоступные электроны, свободно движущиеся по металлической решетке.
- Данный тип связи обеспечивает металлам хорошую проводимость тепла и электричества, а также пластичность и малую твердость.
- Металлическая связь обусловливает возможность формирования различных сплавов путем смешивания различных металлов.
- Металлические связи обладают высокой прочностью, что обеспечивает металлам высокую теплопроводность и механическую стойкость.
Сравнение типов химических связей
Ионная связь:
- Возникает между ионами с противоположными зарядами.
- Образует кристаллические решетки.
- Характеризуется высокой температурой плавления и кипения.
Ковалентная связь:
- Образуется путем обмена электронами.
- Может быть полярной или неполярной.
- Образует молекулы и кристаллы.
Металлическая связь:
- Характеризуется общими электронами, образующими "электронное море".
- Дает металлам хорошую тепло- и электропроводность.
- Образует кристаллические структуры с определенным упорядочением.
Влияние видов связей на свойства веществ
Виды химических связей, такие как ионная, ковалентная и металлическая, имеют прямое влияние на свойства веществ.
Ионная связь образуется между ионами с противоположным зарядом. Вещества с ионной связью обычно обладают высокой температурой плавления и кипения, хорошей проводимостью электричества в расплавленном или растворенном состоянии.
Ковалентная связь характеризуется обменом электронами между атомами. Вещества с ковалентной связью обычно имеют низкую температуру плавления и кипения, неметаллический характер, а также слабую проводимость электричества.
Металлическая связь возникает между атомами металлов. Металлические вещества обладают хорошей теплопроводностью и электропроводностью, имеют блестящую поверхность и способны легко подвергаться деформации.
Примеры соединений с разными видами связей
Ниже приведены примеры различных соединений, демонстрирующих разнообразие видов химических связей:
| Вид связи | Пример соединения |
|---|---|
| Ионная связь | Хлорид натрия (NaCl) |
| Ковалентная связь | Молекула воды (H2O) |
| Металлическая связь | Железо (Fe) |
Значимость и применение знаний о видов химических связей
Ионные связи особенно важны в области электрохимии, где они играют ключевую роль в реакциях электролиза и образовании ионов в растворах.
Ковалентные связи используются в химии органических соединений, полимеров, фармацевтики и многих других областях для создания стабильных молекул и материалов.
Металлические связи широко применяются в металлургии, электротехнике, строительстве и других отраслях промышленности.
Таким образом, знание о различных видах химических связей не только помогает ученым понимать химические процессы в природе, но и открывает новые возможности для развития технологий и создания новых материалов.
Вопрос-ответ

Что такое ионная химическая связь?
Ионная связь – это тип химической связи, при котором атомы обмениваются электронами, образуя ионы с противоположным зарядом. В результате образуется электростатическое притяжение между ионами с разными зарядами, что удерживает их вместе.
Каков принцип образования ковалентной связи?
Ковалентная связь возникает, когда два атома делят одну или несколько пар электронов. Оба атома в этой связи используют общие электроны для создания устойчивой молекулы. Такие связи обычно образуются между неметаллами.
В чем заключается особенность металлической связи?
Металлическая связь образуется между атомами металлов, где внешние электроны свободно перемещаются по кристаллической решетке металла. Это приводит к образованию «электронного облака», которое удерживает положительно заряженные атомы металла вместе.
Какие свойства характерны для ионных соединений?
Ионные соединения имеют высокую температуру плавления и кипения, хорошую проводимость электричества в расплавленном состоянии или в растворе, формируют кристаллическую структуру и обычно образуются между металлом и неметаллом.
Какие атомы могут образовывать ковалентные связи?
Ковалентные связи могут образовываться между атомами неметаллов, таких как углерод, кислород, азот, фтор и т.д. Эти атомы обычно имеют высокую электроотрицательность, что способствует образованию ковалентной связи за счет общих электронных пар.