Цинк – металл с атомным номером 30 в периодической таблице химических элементов. Он отличается относительной устойчивостью при обычных условиях и обладает рядом интересных химических свойств.
При контакте с кислородом цинк образует характерную пленку оксида, которая защищает металл от дальнейшей окислительной реакции. Это делает его применимым в различных областях, включая строительство, производство автомобилей и электротехнику.
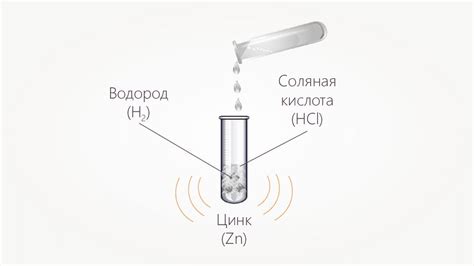
Реакция цинка с кислотами, например, соляной кислотой, происходит с выделением водорода, что можно наблюдать при проведении экспериментов в химической лаборатории. Цинк также хорошо растворяется в щелочах, образуя комплексные соединения.
Химические свойства цинка

Основные химические свойства цинка:
- Химический символ: Zn
- Относительная атомная масса: 65,38 г/моль
- Плотность: 7,14 г/см³
- Температура плавления: 419,5 °C
- Температура кипения: 907 °C
Цинк обладает способностью образовывать различные соединения, включая оксид цинка (ZnO), хлорид цинка (ZnCl2) и сульфат цинка (ZnSO4), которые находят широкое применение в промышленности и в медицине. Важным свойством цинка является его антикоррозийная способность, которая делает его эффективным компонентом в производстве защитных покрытий и гальванических покрытий.
Реакция цинка с кислородом
Цинк обладает способностью реагировать с кислородом в воздухе, образуя оксид цинка. Реакция проходит с выделением тепла и осуществляется по следующему уравнению:
2Zn(s) + O2(g) → 2ZnO(s).
Полученный оксид цинка образует защитную пленку на поверхности металла, что предотвращает его окисление дальше и сохраняет металлический блеск цинка.
Взаимодействие цинка с кислотами

Цинк обладает активностью в реакциях с некоторыми кислотами. Например, соляная кислота (HCl) реагирует с цинком, образуя хлорид цинка и выделяя водородный газ:
- Zn + 2HCl → ZnCl2 + H2↑
Цинк также реагирует с серной кислотой (H2SO4), образуя сульфат цинка и водородный газ:
- Zn + H2SO4 → ZnSO4 + H2↑
Эти реакции являются типичными примерами химического взаимодействия цинка с кислотами и позволяют использовать цинк для некоторых химических преобразований.
Цинк в щелочной среде

В щелочной среде цинк нетоксичен и стабилен. Это связано с образованием защитной пленки оксида цинка на поверхности металла, которая предотвращает его дальнейшее окисление. В присутствии щелочи и кислорода, цинк может образовывать комплексные соединения, такие как цинкаты. Цинк способен образовывать гидроксиды и основания, проявляя амфотерные свойства. Его растворы в щелочах могут использоваться в различных химических процессах, таких как электролиз водных растворов для получения водорода.
Формирование оксида цинка

Оксид цинка (ZnO) образуется в результате реакции цинка с кислородом при высоких температурах. При нагревании металлического цинка до 800-900 градусов Цельсия в присутствии кислорода происходит образование оксида цинка:
2Zn + O2 → 2ZnO
Оксид цинка имеет белый цвет в чистом виде и широко применяется в промышленности, медицине, косметике, и других отраслях благодаря своим уникальным химическим и физическим свойствам.
Реакция цинка с водой

Цинк обладает способностью реагировать с водой, хотя эта реакция происходит не так интенсивно, как, например, реакция натрия. При контакте цинка с водой возникает химическая реакция, в результате которой образуется гидроксид цинка и выделяется водород. Уравнение реакции выглядит следующим образом:
| Zn(s) + 2H₂O(l) → Zn(OH)₂(aq) + H₂(g) |
Образовавшийся гидроксид цинка обычно выпадает в осадок в виде мутной белой массы. Реакция цинка с водой проходит медленно, что делает этот металл более устойчивым к окружающей среде, по сравнению с металлами, реакция которых с водой идет более интенсивно.
Образование солей цинка

Соли цинка получаются путем реакции цинка с кислотами. Например, хлорид цинка (ZnCl2) может быть получен обработкой цинка хлороводородной кислотой (HCl):
Zn + 2HCl → ZnCl2 + H2
Также цинк образует сульфат, нитрат, и другие соли при взаимодействии с соответствующими кислотами. Образующиеся соли могут использоваться в различных промышленных процессах и химических реакциях.
Изменение свойств цинка при высокой температуре
При повышении температуры цинк выходит на реакцию с воздухом. При нагревании его в кислороде до 100-150° С цинк начинает гореть с ярким светом, образуя цинковый оксид:
| 4Zn + O2 → 2ZnO |
Также цинк может реагировать с кислородом при нагревании в присутствии углекислого газа, образуя цинковый карбонат:
| 2Zn + O2 + CO2 → 2ZnCO3 |
При достаточно высокой температуре цинк подвергается термическому разложению, превращаясь в цинкоксид и металлический цинк:
| 2ZnO → 2Zn + O2 |
Вопрос-ответ

Что происходит при реакции цинка с кислородом?
При воздействии кислорода на цинк происходит окисление металла до оксида цинка. Реакция протекает по следующему уравнению: 2Zn + O2 -> 2ZnO. Образовавшийся оксид цинка имеет характерный жёлтый цвет.
Какие свойства образованного при окислении цинкового порошка оксида цинка?
Оксид цинка обладает полупроводниковыми свойствами, а также является хорошим катализатором различных химических реакций. Этот компаунд находит применение в различных отраслях промышленности и медицине.
Как реагирует цинк с кислотой?
Цинк обладает высокой активностью и может реагировать с различными кислотами, например, с соляной кислотой или серной кислотой. При взаимодействии происходит образование соли и выделение водорода газа: Zn + 2HCl -> ZnCl2 + H2.
Каким образом цинк взаимодействует с водой?
Цинк реагирует с водой с образованием гидроксида цинка и выделением водорода: Zn + 2H2O -> Zn(OH)2 + H2. В данном случае происходит замена водорода в молекуле воды на цинк.



