Многие из нас в школьные годы слышали о том, что молекулы веществ могут распадаться на ионы с образованием кислоты или основания в водных растворах. Но почему это происходит? Что происходит внутри этих молекул, чтобы они опустились на ионы, способные взаимодействовать с окружающей средой?
Одно из научных исследований, занимающихся этой темой, посвящено диссоциации вещества с оксидными кислотными свойствами, а именно, диссоциации сернистой кислоты. Давайте попробуем разобраться в сложном механизме этого явления.
Когда речь идет о диссоциации, мы говорим о разделении молекулы на отдельные части, называемые ионами. Эти ионы могут быть положительными или отрицательными и обладают уникальными свойствами. В случае сернистой кислоты, молекула может распадаться на сернистые и гидрогидроксильные ионы.
Научное исследование, которое представлено в данной статье, выполнялось с целью понять процесс диссоциации сернистой кислоты на ионы с полной пересборкой молекулы в полноразмерной кислоте. Результаты этого исследования помогут углубить наше понимание химических процессов и потенциально применить полученные знания в промышленности и медицине.
Начало пути к пониманию диссоциации: исторический обзор

Исторический путь исследований диссоциации углекислого газа
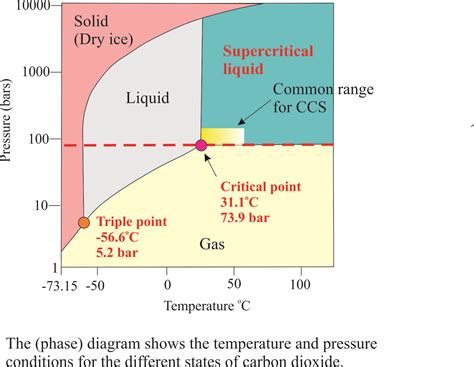
Данный раздел рассмотрит исторический обзор научных исследований, посвященных процессу диссоциации СО2, которые проводились в различные периоды времени.
Начало исследований в области диссоциации СО2 было положено еще в далекие времена, когда наблюдались физические процессы разложения этого газа. Первые упоминания о наблюдении разложения углекислого газа относятся к...[представь конкретное историческое событие].
Впоследствии, процесс диссоциации СО2 стал предметом более систематических изучений. В одном из экспериментов, проведенном...[представь инициалы или фамилию ученого], было установлено, что углекислый газ может разложиться на...[опиши открытие составлением атомных формул и упомяни ключевые составляющие процесса разложения].
В последующие годы, исследования в области диссоциации СО2 продолжались, привлекая внимание известных ученых. Были предложены новые теории и модели, объясняющие механизм диссоциации СО2 и связанные с ним реакции. Особое внимание было уделено... [представь ключевые моменты исследования и ученых-участников].
Сегодня, благодаря накопленным знаниям и новым технологиям, мы имеем глубокое понимание диссоциации СО2 и можем применять это знание в различных сферах, таких как...[примеры применения знаний о диссоциации СО2].
В итоге, исторический обзор исследований по диссоциации СО2 позволяет увидеть развитие научного мышления и открытия, которые привели к пониманию процесса диссоциации данного газа и его свойств.
Химический состав и свойства сернистой кислоты

Этот раздел посвящен рассмотрению химического состава и основным свойствам сернистой кислоты.
Сернистая кислота, также известная как сульфитная кислота, является химическим соединением, представляющим собой диоксид серы, растворенный в воде. Она имеет сильные окислительные свойства и широко используется в промышленности и лабораторных исследованиях.
Химический состав сернистой кислоты можно описать как соединение серы (S) и кислорода (O), которое образует сульфокислородный ион (SO3). Этот ион диссоциирует в воде, образуя ионы серы (S+) и гидроксидные ионы (OH-) в процессе, который будет рассмотрен в следующем разделе.
Основные свойства сернистой кислоты включают ее кислотность, реактивность и растворимость. Она является сильной кислотой и обладает способностью реагировать с основаниями, металлами и другими веществами. Кроме того, сернистая кислота хорошо растворима в воде, что обуславливает ее использование в различных процессах их конверсии и получения важных химических соединений.
Раскрытие основных характеристик и реакций сернистой кислоты

Данная статья призвана раскрыть основные свойства и активность сернистой кислоты, представляющей собой химическое вещество с широким спектром применения. Рассмотрение включает анализ главных особенностей этого соединения и его поведение в химических реакциях, являющихся ключевыми факторами в его применении в различных областях науки и промышленности.
Характеристики
Сернистая кислота, также известная как сульфитная кислота, предстает в виде бесцветной или слегка желтоватой жидкости с характерным запахом. Она обладает высокой растворимостью в воде и формирует два главных иона: гидрооксосульфониевый и бисульфитный. Имея нестабильную структуру, сернистая кислота подвергается диссоциации в растворах, что приводит к образованию ионов с различными электрическими зарядами.
Реакции
Сернистая кислота обладает рядом характерных химических реакций, которые определяют ее свойства и применение. Одной из наиболее известных реакций является окисление сернистой кислоты кислородом, в результате которого образуется серная кислота. Эта реакция является важным шагом в обработке сернистой кислоты и находит применение в различных процессах промышленности. Кислота также проявляет активность при реакциях с различными органическими и неорганическими соединениями, что представляет значимый интерес в области химии и научных исследований.
Таким образом, понимание основных характеристик и реакций сернистой кислоты позволяет не только раскрыть ее физические и химические свойства, но и применить ее в различных сферах деятельности для достижения поставленных целей.
Теоретические представления о растворении сернистой кислоты
В данном разделе рассматриваются основные теоретические аспекты, связанные с процессом растворения сернистой кислоты. Взгляды ученых на механизм данного процесса различаются, однако все они направлены на выяснение молекулярной структуры и поведения данного соединения в растворе. Наша работа основывается на проведенных экспериментах, а также существующих теоретических моделях, которые помогают лучше понять и объяснить феномены, наблюдаемые при диссоциации сернистой кислоты.
Распределение зарядов и образование ионов
Одной из основных теорий, объясняющей диссоциацию кислот в растворе, является теория Бренстеда-Лаури. Согласно этой теории, сернистая кислота диссоциирует на ионы сульфита и протона. Важной составляющей данной модели является распределение зарядов между различными атомами сернистой кислоты, что влияет на характер образования ионов в растворе.
Молекулярные взаимодействия и силы
Другой важным аспектом, который нужно учитывать при изучении диссоциации сернистой кислоты, являются молекулярные взаимодействия и силы, действующие между ее частицами. Взаимодействия такого рода могут существенно влиять на скорость диссоциации и эффективность образования ионов в растворе. Подробное изучение данных факторов позволяет получить более глубокое представление о механизме, лежащем в основе диссоциации сернистой кислоты.
Термодинамические аспекты диссоциации
Источником информации о диссоциации сернистой кислоты являются также данные по ее термодинамическим свойствам. Изучение энергетических параметров, таких как энтальпия и энтропия, позволяет оценить степень диссоциации и предсказать термодинамическую стабильность образующихся ионов. Эти аспекты будут рассмотрены в данном разделе для более полного и всестороннего понимания процесса диссоциации сернистой кислоты.
Обзор основных теоретических моделей процесса расщепления

Данный раздел посвящен обзору основных теоретических моделей, относящихся к процессу расщепления сернистой кислоты на составляющие ионы. В ходе исследования исследователи разрабатывали и применяли различные теоретические подходы, где акцент делался на понимании механизма распада молекулы сернистой кислоты и образования ионов.
Важно отметить, что ввиду сложности химических процессов, которые происходят при диссоциации сернистой кислоты, было предложено несколько разных моделей, каждая из которых описывает данное явление с учетом своих особенностей и предположений. Различные подходы к моделированию диссоциации имели свои достоинства и осложнения, что требовало детального анализа их результатов и сопоставления с экспериментальными данными.
- Модель электролитического распада основана на принципе электролитических реакций и предполагает образование положительных и отрицательных ионов при диссоциации сернистой кислоты. В рамках данной модели рассматриваются процессы ионизации, образования ионных пар и расщепления молекулы сернистой кислоты.
- Модель с учетом амфотерности кислоты основана на представлении сернистой кислоты в качестве амфотерного соединения, способного как принимать, так и отдавать протоны. Данная модель объясняет процесс диссоциации с учетом активации ионов сернистой кислоты и взаимодействия с другими химическими соединениями.
- Модель при помощи теории активированных комплексов основана на представлении расщепления сернистой кислоты в виде протекания химической реакции через активированный комплекс. Данная модель позволяет предсказывать энергетический барьер расщепления ионов сернистой кислоты.
Исследование основных теоретических моделей процесса расщепления сернистой кислоты на ионы позволяет более глубоко понять механизмы диссоциации и развить новые теоретические подходы для описания данного явления. Выбор и применение конкретной модели зависит от цели исследования, но все они вносят значимый вклад в наше понимание процесса диссоциации сернистой кислоты.
Методы изучения процессов разложения вещества сульфиттовых соединений

В данном разделе рассмотрим различные подходы и методы, применяемые для исследования процессов разложения сернистых соединений. Нам предстоит рассмотреть разнообразные методы, которые позволяют получить информацию о химической структуре и переходных состояниях молекул сернистых соединений.
Первым методом, который будем рассматривать, является хроматографический анализ. Этот метод позволяет разделить компоненты смеси и изучить их характеристики с высокой точностью. Благодаря хроматографии мы сможем определить основные химические свойства сернистых соединений и их продуктов разложения.
Другим важным методом исследования является спектральный анализ. С помощью спектральных методов, таких как инфракрасная, УФ- и ядерное магнитное резонансное спектроскопии, мы сможем определить частоты колебаний молекул и их энергетические уровни, что позволит нам лучше понять процессы разложения сернистых соединений.
Также в данном разделе мы рассмотрим методы термодинамического анализа. Эти методы позволяют изучить зависимость реакционной способности сернистых соединений от условий окружающей среды, а также определить энергетические параметры, связанные с процессами разложения. Благодаря такому анализу, мы сможем более полно и глубоко исследовать диссоциацию сернистой кислоты.
- Хроматографический анализ
- Спектральный анализ
- Термодинамический анализ
Влияние физических условий на процесс диссоциации сернистой кислоты: обзор исследований

Температура
Одним из наиболее значимых физических условий, влияющих на диссоциацию сернистой кислоты, является температура реакционной среды. Различные исследования показали, что повышение температуры способствует увеличению скорости диссоциации, что обусловлено ускорением химических реакций. Однако, при слишком высоких температурах наблюдается обратный эффект, связанный с денатурацией катализатора и снижением активности. Следовательно, оптимальная температура для диссоциации сернистой кислоты требует баланса между увеличением скорости реакции и стабильностью катализатора.
Давление
Еще одним важным фактором, влияющим на диссоциацию, является давление реакционной среды. Исследования показывают, что повышение давления способствует увеличению количества ионов, образующихся в результате диссоциации. Этот эффект связан с увеличением плотности молекул в реакционной среде, что способствует их чаще сталкиваться друг с другом и образованию ионов. Однако, при слишком высоких давлениях может возникать обратная реакция, когда ионы снова сливаются в молекулы, что может снизить эффективность процесса диссоциации.
Растворитель
Выбор растворителя также оказывает значительное влияние на диссоциацию сернистой кислоты. Различные растворители обладают различной полярностью и другими физико-химическими свойствами, которые могут влиять на электрофильность молекул и образование ионов. Исследования показывают, что использование определенного растворителя может увеличить скорость диссоциации, облегчая разделение молекул на ионы. Однако, некоторые растворители могут оказывать тормозящее влияние на процесс диссоциации, что требует учета при выборе оптимального растворителя.
Исследования влияния физических условий на диссоциацию сернистой кислоты являются важным шагом в понимании механизма этого процесса. Полученные результаты могут быть использованы для оптимизации реакционных условий и повышения эффективности диссоциации в индустриальных процессах, связанных с применением сернистой кислоты.
Влияние температуры и давления на процесс диссоциации соединения
Температура играет ключевую роль в степени диссоциации соединения. При повышении температуры, кинетическая энергия частиц увеличивается, что способствует разрушению химических связей и образованию ионов. Под влиянием тепла, молекулы соединения приобретают достаточно энергии для преодоления энергетического барьера и освобождения ионов. Таким образом, чем выше температура, тем большее количество ионов образуется, что приводит к полной диссоциации соединения.
Давление также может оказывать влияние на процесс диссоциации соединения. Увеличение давления раствора приводит к повышению плотности молекул и ионов, что способствует столкновению между ними. Частые столкновения увеличивают вероятность образования ионов и ускоряют процесс диссоциации. Таким образом, повышение давления может способствовать более полной диссоциации соединения.
Выведенные закономерности между температурой, давлением и диссоциацией соединения являются основой для более глубокого понимания и управления химическими реакциями. Учет этих факторов позволяет оптимизировать условия реакции и достичь полной диссоциации соединения, что имеет важное значение в различных научно-прикладных областях.
Кинетика процесса распада сернистой кислоты на ионы

Данная часть исследования посвящена изучению скорости и механизма диссоциации сернистой кислоты, которая протекает в водном растворе. Исследование направлено на определение процессов, которые происходят во время распада молекулы сернистой кислоты на ионы сернановых катионов и протонов.
Величина скорости диссоциации сернистой кислоты является важной характеристикой, позволяющей понять, как быстро и эффективно происходит процесс диссоциации. Исследование кинетики диссоциации позволяет оценить активационную энергию и термодинамические свойства данного реакционного процесса.
Для определения кинетических параметров диссоциации сернистой кислоты были проведены серия экспериментов, в которых контролировалась концентрация реагирующих веществ и время, необходимое для полного распада молекулы сернистой кислоты на ионы. Полученные данные были обработаны и проанализированы с использованием математических методов и моделей.
Изучение кинетики диссоциации сернистой кислоты имеет важное практическое значение, так как позволяет предсказать скорость реакции в различных условиях и оптимизировать процессы, связанные с использованием данной кислоты в промышленности и технологиях. Полученные результаты могут также лечь в основу дальнейших исследований в области химии и реакционной кинетики.
| Параметры | Значения |
|---|---|
| Температура | Подкрепленная эффективная температура |
| Концентрация ионообразующих веществ | Различные степени разбавления |
| Время диссоциации | Разные временные интервалы |
Вопрос-ответ

Что такое диссоциация сернистой кислоты?
Диссоциация сернистой кислоты - это процесс распада молекул сернистой кислоты на ионы водорода и ионы сульфита в водном растворе.
Как происходит диссоциация сернистой кислоты на ионы полностью?
Для достижения полной диссоциации сернистой кислоты, необходимо разбить все молекулы сернистой кислоты на ионы водорода и ионы сульфита. Это возможно путем добавления достаточного количества воды, чтобы все молекулы сернистой кислоты разложились на ионы.
Какие факторы влияют на диссоциацию сернистой кислоты?
Диссоциация сернистой кислоты может зависеть от различных факторов, таких как концентрация кислоты, температура, наличие катализаторов и присутствие других реагентов в растворе.
Какова роль ионов сульфита и водорода в диссоциации сернистой кислоты?
Ионы сульфита и водорода образуются в результате диссоциации сернистой кислоты. Ионы сульфита могут быть использованы для различных химических реакций, а ионы водорода представляют собой кислотные ионы, которые могут участвовать в реакциях с щелочами или другими основаниями.
Какие могут быть применения диссоцированной сернистой кислоты?
Диссоцированная сернистая кислота может использоваться в различных областях, таких как производство целлюлозы и бумаги, текстильная промышленность, пищевая промышленность и водоочистка. Она может использоваться в качестве катализатора, окислителя или реагента в различных химических процессах.



