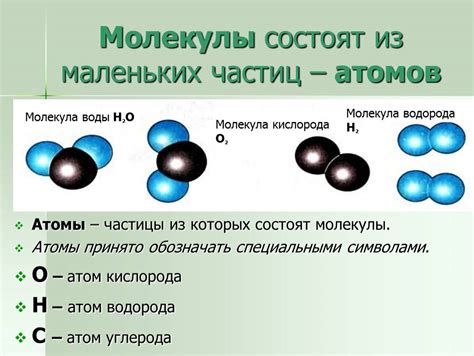
Вода – одно из основных веществ в природе, присутствующее во всех формах жизни на планете Земля. Ее молекула состоит из двух атомов водорода и одного атома кислорода, образуя уникальную структуру с характерными свойствами.
Пар, в свою очередь, представляет собой газообразное состояние воды, когда молекулы воды из жидкого состояния переходят в газовое под воздействием тепла. Пар - это важный компонент атмосферы, который играет значительную роль в процессах обмена влагой и климатических явлениях.
Различия между молекулами воды и пара лежат не только в их физическом состоянии, но и в кинетических и химических свойствах. Эти структуры взаимодействуют в природе, обеспечивая уникальные процессы и явления, необходимые для жизни на Земле.
Структура молекулы воды
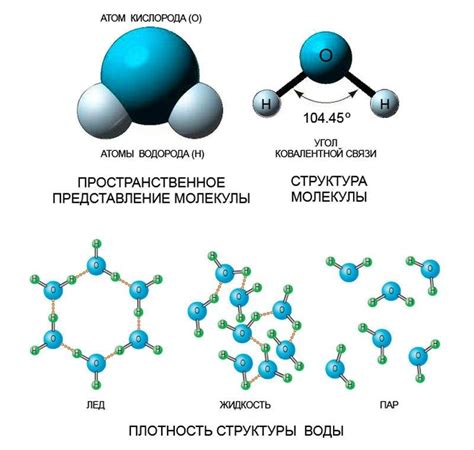
Молекула воды состоит из двух атомов водорода и одного атома кислорода
Атом кислорода сильнее притягивает электроны, образуя положительную и отрицательную части молекулы
- Отрицательные части молекулы воды (O-группы) притягивают положительные части других молекул, что обеспечивает образование водородных связей
- Эти водородные связи придадут молекуле воды определенную структуру и свойства, повышая ее кипящую точку и теплоемкость
Атомы кислорода и водорода
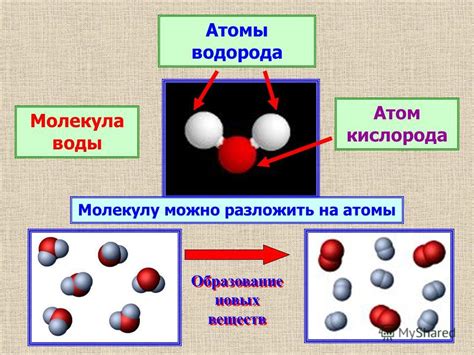
Атом кислорода обладает более крупным радиусом, чем атом водорода, что приводит к тому, что молекула воды имеет углеклассический вид. В результате этой структуры, в молекуле воды есть зона относительно более отрицательного заряда возле атома кислорода и зона относительно более положительного заряда возле атомов водорода, что делает молекулу воды полярной.
Угол между атомами
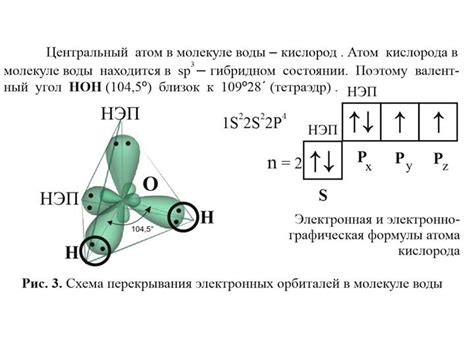
Один из ключевых параметров, отличающих молекулы воды и пара, это угол между атомами водорода и кислорода. В случае воды он составляет примерно 104.5°, что придает молекуле характерную форму капли. Этот угол обусловлен строением электронных облаков в молекуле воды, которые формируются за счет взаимодействия атомов. В паре же угол между атомами водорода и кислорода ближе к 180° из-за отсутствия внутренних взаимодействий между молекулами пара.
Особенности молекулы пара
Молекула пара представляет собой состояние вещества, при котором молекулы воды находятся в испаренном состоянии. Основные особенности молекулы пара включают:
- Газообразное состояние: молекулы пара двигаются быстро и имеют высокую энергию.
- Отсутствие фиксированной формы: пар не имеет определенной формы, а заполняет все доступное пространство.
- Возможность существования при различных температурах: пар образуется при испарении воды и может существовать при разной температуре. Например, вода может испаряться и образовывать пар как при комнатной температуре, так и при кипении.
- Возможность конденсации: при охлаждении пара может конденсироваться обратно в жидкость.
Поведение молекул пара при нагревании
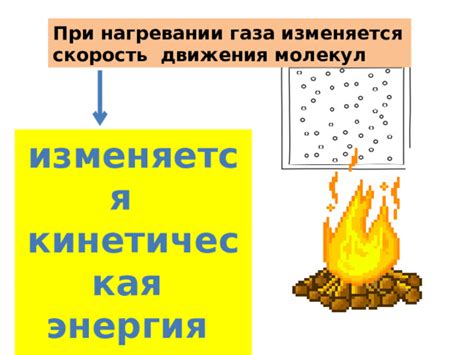
При нагревании молекулы воды в жидкой фазе приобретают дополнительную энергию, что приводит к возрастанию их кинетической энергии.
Это позволяет им преодолеть взаимное притяжение и перейти в газовую фазу – состояние пара.
В газовой фазе молекулы пара движутся быстрее, чем в жидкой фазе, благодаря чему они способны занимать больше объема и становятся менее плотными.
Вопрос-ответ

Чем отличаются молекулы воды от молекул пара?
Молекулы воды – это молекулы водяного состояния, а молекулы пара – это молекулы водяного пара. Основное отличие состоит в том, что молекулы воды находятся в жидком состоянии, образуя жидкость, а молекулы пара образуют пар – газообразное состояние воды. Молекулы воды имеют более близкие межмолекулярные взаимодействия, чем молекулы пара, что обуславливает различия в их физических свойствах.
Каковы основные особенности молекул воды и пара?
Молекулы воды имеют полярную структуру, что обуславливает их способность образовывать водородные связи. Эти межмолекулярные взаимодействия придают воде высокую устойчивость и специфические свойства, такие как поверхностное натяжение и аномальное изменение плотности при замерзании. В то же время молекулы пара являются независимыми, свободно двигающимися в газообразном состоянии и имеют более высокую энергию, чем молекулы воды.