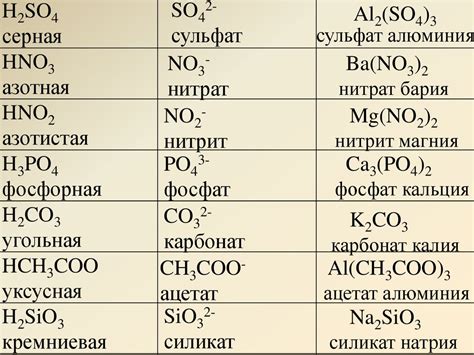
Карбонат и катион водорода – два важных химических соединения, которые играют значительную роль в мире химии и биологии. Карбонат является солью угольной кислоты и обладает многочисленными свойствами, которые делают его важным для различных процессов в природе и промышленности.
Карбонат известен как основной анион в большинстве карбонатов и бикарбонатов, таких как кальций карбонат (известный как мрамор) или натрий карбонат (просто поваренная сода). Его структура и свойства позволяют использовать его в широком спектре отраслей, от производства стекла до регулирования кислотности в воде.
Катион водорода, или просто протон, является важным элементом для понимания кислотно-основных реакций и реакций окисления-восстановления. Он является основным игроком в заряженных реакциях, а его концентрация в растворе может иметь решающее значение для химических процессов.
Карбонат и катион водорода: важные аспекты

Катион водорода, или просто ион водорода, играет важную роль в кислотно-основных взаимодействиях. Он является основой определения pH вещества и является ключевым параметром в химических процессах.
Определение и свойства карбоната
Карбонаты обладают свойством растворяться в воде и образовывать растворы с щелочной реакцией. Кроме того, некоторые карбонаты способны выделяться из раствора в виде осадка при изменении условий среды, например, при изменении температуры или концентрации раствора.
Одним из интересных свойств карбоната является его способность реагировать с кислотами и образовывать соли карбоновой кислоты, которые также могут образовывать растворы или выпадать в виде осадка.
Химическая формула карбоната
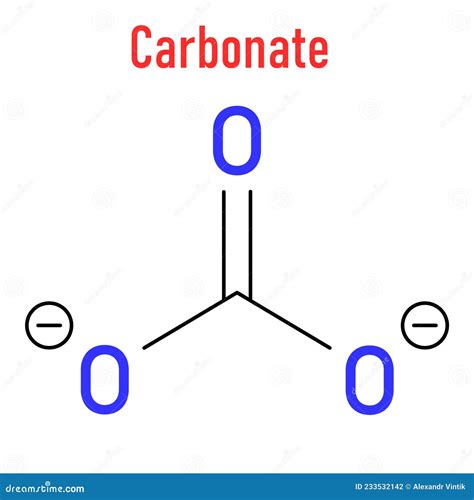
Таким образом, в молекуле карбоната содержится один атом углерода и три атома кислорода, а общий заряд равен -2, что указывает на наличие двух отрицательных зарядов у аниона.
Реакции карбоната с катионами водорода

Карбонаты, такие как гидрокарбонат кальция (Ca(HCO₃)₂) или гидрокарбонат натрия (NaHCO₃), могут реагировать с катионами водорода, например, H⁺ из сильных кислот, таких как HCl. Когда карбонат встречает катион водорода, происходит нейтрализационная реакция, в результате которой образуется углекислый газ, вода и соответствующие соли. Например, реакция между гидрокарбонатом натрия и HCl приводит к образованию углекислого газа (CO₂), воды (H₂O) и хлорида натрия (NaCl).
Влияние карбоната на pH растворов

Карбонат влияет на pH растворов за счет образования гидрокарбонат-ионов и углекислого газа при реакции с водой. В результате увеличивается содержание гидрокарбонат-ионов, что повышает pH раствора.
Реакция карбоната с водой приводит к образованию гидрокарбоната и ионов водорода. Гидрокарбонат-ионы играют важную роль в буферизации растворов, позволяя поддерживать относительно стабильный pH в широком диапазоне.
При добавлении карбоната в раствор происходит рост содержания гидрокарбоната, что может привести к изменению pH в сторону щелочности. Этот процесс важен при регулировании pH водных систем и имеет значение в химических процессах и технологиях.
Анализ карбоната в лаборатории

Анализ содержания карбоната можно провести с помощью различных методов, таких как:
- Метод титрования: карбонат может быть определен титрованием сильным кислотным раствором с использованием индикатора или pH-метра.
- Метод гравиметрии: карбонат можно выделить в виде осадка при помощи хлорида бария или кальция, после чего провести его взвешивание.
- Использование спектральных методов: такие как инфракрасная спектроскопия или рентгеноструктурный анализ, которые позволяют определить наличие карбоната.
Для точного анализа карбоната в лаборатории важно проводить все необходимые испытания и контрольные измерения, следовать стандартным процедурам и экспериментальным методикам.
Применение карбоната в промышленности

Кроме того, карбонат водорода находит применение в производстве щелочей, красителей, пластмасс, бумаги и других материалов. Этот вещество также используется в процессах очистки воды и загрязненных веществ, что делает его незаменимым компонентом в промышленности.
Вопрос-ответ

Что такое карбонат и катион водорода?
Карбонат – это соль угольной кислоты, обычно представленная в виде ионов CO3^2-. Катион водорода – это положительно заряженный ион водорода, H+. Оба этих понятия играют важную роль в химии и находят применение в различных процессах.
Какие свойства имеют карбонат и катион водорода?
Карбонаты обладают щелочными свойствами, способны реагировать с кислотами, образуя соли, и участвуют в буферных растворах. Катионы водорода могут сформировать кислотные растворы, они участвуют в металлических замещениях и могут взаимодействовать с анионами для образования кислотных солей.



