Молекулы веществ - это основные строительные единицы всех материалов, окружающих нас. Их притяжение друг к другу играет ключевую роль в различных физических и химических свойствах веществ. Однако это притяжение может существенно различаться в зависимости от типа молекул и их химической природы.
В данной статье мы рассмотрим, какие различия в притяжении молекул можно наблюдать в разных веществах и как эти различия влияют на их свойства. От простых молекул воды и этилового спирта до сложных полимерных цепей, каждое вещество обладает своим уникальным типом молекулярного притяжения, определяющим его поведение в различных условиях.
Притяжение молекул: где начинается химия

Все вещества, которые нас окружают, состоят из молекул. Молекулы обладают притяжением друг к другу, которое определяет их физические и химические свойства. Взаимодействие молекул через притяжение играет ключевую роль в химических реакциях и образовании различных веществ.
Сила притяжения молекул зависит от типа вещества и его состава. Например, молекулы воды обладают сильным притяжением благодаря водородным связям, что делает воду жидкой при комнатной температуре. С другой стороны, вещества с меньшей силой притяжения могут быть газообразными или твердыми.
Таким образом, понимание притяжения молекул является основой для изучения химии и позволяет объяснить множество явлений в мире веществ. От простейших веществ до сложных соединений, притяжение молекул является тем ключевым элементом, который определяет их свойства и поведение.
Межмолекулярные силы: типы и принципы
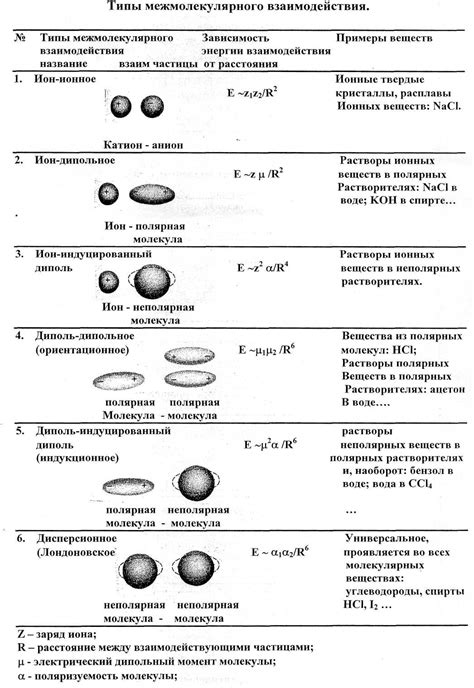
Водородные связи – это одна из наиболее сильных межмолекулярных сил, которая возникает между молекулами водородсодержащих веществ (например, воды). Они обусловлены взаимодействием водородных атомов с электроотрицательными атомами, что приводит к образованию устойчивых структур.
Ван-дер-Ваальсовы силы – это слабые силы, которые возникают благодаря моментам диполя или квадроля молекулы. Они играют важную роль в многих веществах, особенно в газах и некоторых жидкостях.
Ионо-дипольные взаимодействия – это силы, возникающие между ионами и полярными молекулами. Они также способствуют формированию устойчивых структур и определяют химические и физические свойства многих веществ.
Понимание типов межмолекулярных сил важно для понимания поведения веществ различной природы и их взаимодействия. Они играют ключевую роль в химических реакциях, фазовых переходах и многих других явлениях в природе.
Гидрофобные и гидрофильные вещества: разница в притяжении
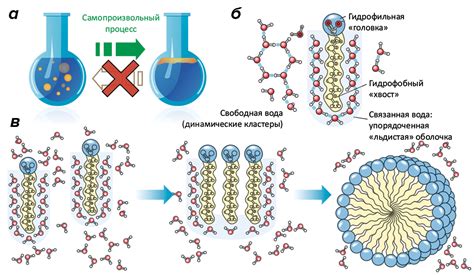
Гидрофобные вещества, такие как жиры и масла, не любят притягиваться к воде из-за их гидрофобных характеристик. В то время как гидрофильные вещества, например соль или сахар, имеют сильное притяжение к воде из-за их гидрофильности.
Это различие в притяжении молекул основано на химической структуре вещества и его способности устанавливать взаимодействие с водой. Гидрофобные вещества содержат гидрофобные группы, которые отталкивают воду, в то время как гидрофильные вещества содержат гидрофильные группы, которые притягивают воду.
Электростатическое притяжение и химические реакции
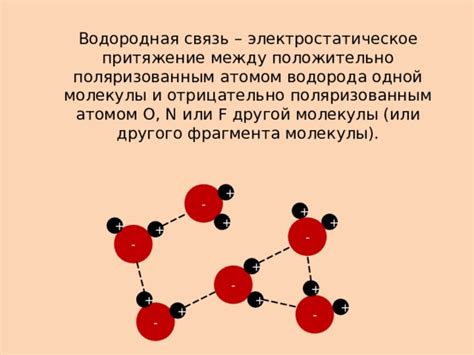
Электростатическое притяжение между молекулами играет важную роль в химических реакциях. Когда молекулы с разными зарядами притягиваются друг к другу, это способствует образованию новых веществ. Например, в реакциях окисления и восстановления электростатическое притяжение между ионами элементов способствует образованию химических соединений.
Взаимодействие между молекулами с разными зарядами также может привести к образованию связей между атомами и молекулами, что является основой для образования сложных химических соединений. Электростатическое притяжение играет ключевую роль в структуре и свойствах многих веществ.
Слабые и сильные связи: секреты вещественного мира

Молекулы веществ обладают различной прочностью связей между атомами, что определяет их свойства и поведение. Существует два типа связей: слабые и сильные.
| Тип связи | Характеристики | Примеры веществ |
|---|---|---|
| Слабые связи | Сравнительно низкая энергия связывания между молекулами или атомами. | Водородные связи, дисперсионные силы, ван-дер-Ваальсовы взаимодействия. |
| Сильные связи | Высокая энергия связывания, обусловленная обменом или передачей электронов. | Ионные связи, ковалентные связи, металлические связи. |
Понимание различий в типах связей помогает объяснить уникальные свойства различных веществ, их способность к образованию кристаллических структур, а также реакции, которые могут происходить между различными молекулами.
Вопрос-ответ

Почему некоторые вещества имеют сильное притяжение молекул, а другие - нет?
Сильное притяжение молекул обусловлено различиями в молекулярной структуре веществ. Например, у веществ с полярными молекулами притяжение обусловлено взаимодействием диполь-диполь, в то время как у неполярных веществ притяжение осуществляется за счет ван-дер-ваальсовских сил. Также важную роль играют силы взаимодействия водородных мостиков в некоторых молекулах, как, например, в воде.
Почему металлы обычно хорошо проводят тепло и электричество?
Металлы обладают хорошей проводимостью тепла и электричества благодаря свободным электронам в их кристаллической решетке. Электроны могут свободно двигаться по общей структуре кристалла, перенося электрический заряд или тепловую энергию. Это обусловливает хорошую проводимость металлов, что делает их ценными материалами для использования в электронике, электротехнике и других областях.