Металлы являются важными элементами в химических реакциях и промышленных процессах благодаря своим уникальным физическим и химическим свойствам. Однако, контакт металлов с кислотами может привести к различным реакциям, которые не всегда могут быть предсказаны.
Взаимодействие металлов с кислотами может привести к образованию солей и выделению водорода, а также к образованию оксидов металлов. Однако, не все металлы одинаково реагируют с кислотами - некоторые металлы более активны, чем другие, и могут вызвать более интенсивные реакции.
Ограничения взаимодействия металлов с кислотами могут быть обусловлены как химическими свойствами металлов, так и свойствами использованных кислот. Поэтому важно учитывать химическую природу металла и кислоты при проведении химических реакций, чтобы избежать нежелательных последствий.
Металлы и кислоты: общие принципы взаимодействия

Важно сохранять баланс: при реакции с кислотой металл должен обеспечить необходимое количество электронов для образования соли, а кислота должна предоставить протоны.
Это взаимодействие имеет свои ограничения, связанные с химической активностью металла и кислоты, а также с условиями реакции, включая концентрацию и температуру.
Реакция металлов с кислотами: химические процессы
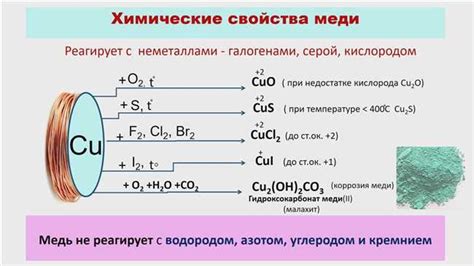
Взаимодействие металлов с кислотами приводит к различным химическим процессам, в зависимости от типа металла и кислоты. Например, реакция цинка с соляной кислотой приводит к образованию хлорида цинка и выделению водорода. Алюминий при взаимодействии с серной кислотой образует алюминий сульфат и высвобождает сернистый газ.
Важно помнить, что не все металлы реагируют с кислотами. Некоторые металлы, такие как золото и платина, не проявляют активной реакции с кислотами. Также стоит учитывать концентрацию кислоты и состояние поверхности металла, так как это может влиять на скорость и характер реакции.
Специфика взаимодействия металлов с различными типами кислот
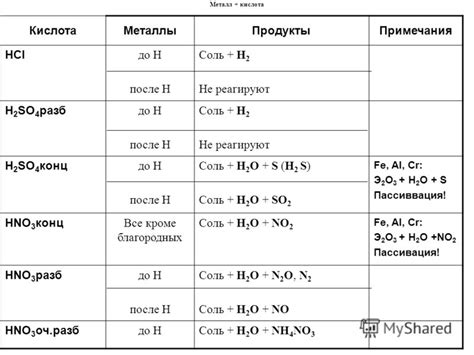
1. Соляная кислота (HCl):
Соляная кислота активно реагирует с металлами, образуя хлориды металлов и выделяя водород. Например, железо (Fe) + 2HCl -> FeCl2 + H2.
2. Серная кислота (H2SO4):
Серная кислота взаимодействует с металлами, образуя соответствующие сульфаты металлов с выделением диоксида серы и натрия. Например, медь (Cu) + H2SO4 -> CuSO4 + SO2 + H2O.
3. Азотная кислота (HNO3):
Азотная кислота окисляет большинство металлов, образуя соответствующие нитраты. Например, цинк (Zn) + 2HNO3 -> Zn(NO3)2 + H2O + NO2.
Важно помнить, что реакция металлов с кислотами происходит с выделением газов, поэтому желательно проводить её в хорошо проветриваемых помещениях.
Особенности реакции цельных и пищевых металлов
Когда речь идет о взаимодействии металлов с кислотами, важно учитывать различия между цельными металлами, такими как железо и медь, и пищевыми металлами, например, алюминий и олово. Цельные металлы могут быстро реагировать с кислотами, образуя соответствующие соли и выделяя водород. При этом происходит образование коррозии или окисления металла.
С другой стороны, пищевые металлы, такие как алюминий, реагируют с кислотами более медленно и в более мягкой форме. Например, реакция алюминия с кислотой может привести к образованию устойчивого оксида алюминия на поверхности металла, что защищает его от дальнейшей коррозии.
Эти особенности реакции цельных и пищевых металлов с кислотами важно учитывать при обращении с металлическими изделиями и при производстве пищевых продуктов.
Ограничения и проблемы при взаимодействии металлов с кислотами
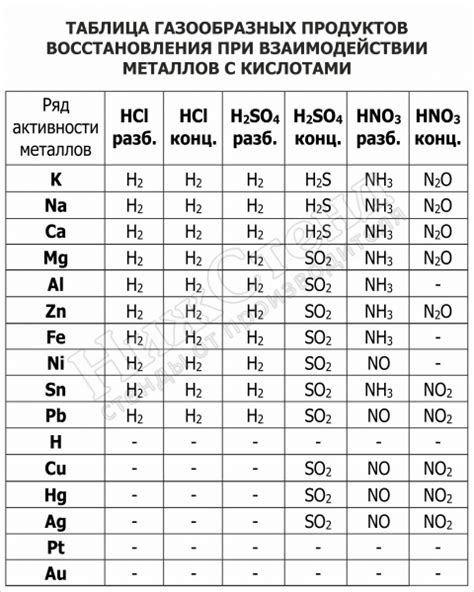
Взаимодействие металлов с кислотами может столкнуться с определенными ограничениями и проблемами, которые необходимо учитывать. Например, некоторые металлы могут реагировать с кислотами слишком активно, приводя к выделению опасных газов или испарений. Это может представлять опасность для здоровья и окружающей среды.
Кроме того, некоторые металлы могут быть несовместимы с определенными видами кислот из-за своей химической структуры или других факторов. Это может привести к неэффективности реакции или даже к образованию токсичных соединений.
Поэтому перед проведением взаимодействия металлов с кислотами необходимо тщательно изучить их химические свойства, возможные реакции и рекомендации по безопасному обращению. Несоблюдение этих мер предосторожности может привести к нежелательным последствиям и опасностям.
Инновационные методы и технологии для улучшения процесса

Для улучшения взаимодействия металлов с кислотами и повышения эффективности этого процесса существует ряд инновационных методов и технологий:
- Использование нанотехнологий для повышения поверхностной активности металлов, что способствует более быстрому и эффективному реагированию с кислотами.
- Применение новых способов обработки металлов, таких как лазерная обработка или электрохимическое полирование, для улучшения площади контакта между металлом и кислотой.
- Разработка специализированных катализаторов и добавок, которые ускоряют процесс взаимодействия металлов с кислотами и повышают его эффективность.
- Внедрение автоматизированных систем контроля и регулирования процесса взаимодействия металлов с кислотами для оптимизации параметров и минимизации ошибок.
Вопрос-ответ

Что происходит при взаимодействии металлов с кислотами?
При взаимодействии металлов с кислотами происходит химическая реакция, в результате которой металл может растворяться или образовывать соли. Это связано с тем, что кислоты обладают способностью отдавать протоны, что приводит к образованию ионов металла.
Какие металлы взаимодействуют с кислотами более активно?
Более активные металлы, такие как натрий, калий, магний, реагируют с кислотами более интенсивно и могут даже выделять водород. Менее активные металлы, такие как цинк, железо, свинец, реагируют менее активно и могут образовывать соли с меньшей степенью растворимости.



