Оксиды металлов - это соединения, состоящие из металла и кислорода. Они являются важными компонентами в производстве металлов, керамики, стекла и других материалов. Прочные и стабильные, они обладают различными свойствами и играют важную роль в различных отраслях промышленности и науке.
У оксидов металлов есть различные формулы, которые определяют их состав и структуру. Некоторые из самых распространенных оксидов металлов включают оксид алюминия (Al2O3), оксид железа (Fe2O3), оксид кальция (CaO) и оксид магния (MgO).
Оксиды металлов имеют различные свойства в зависимости от их состава и структуры. Некоторые оксиды металлов являются неактивными и необладают кислотными или основными свойствами, в то время как другие оксиды являются кислотными или основными. Некоторые оксиды металлов могут обладать полупроводниковыми свойствами или использоваться как каталитические вещества.
Оксиды металлов являются важными соединениями, используемыми в различных отраслях промышленности. Некоторые оксиды металлов, такие как оксид алюминия, находят широкое применение в производстве алюминия и его сплавов. Другие оксиды металлов, такие как оксид кальция, используются в производстве цемента и керамики. Оксиды металлов также используются в электронике, медицине и других областях.
Описания и примеры

Оксиды металлов - это химические соединения, состоящие из атомов металла и кислорода. Они образуются в результате реакции металла с кислородом или окислением металлического соединения.
Примерами оксидов металлов являются оксид железа (Fe2+O3-), оксид алюминия (Al3+O2-) и оксид меди (Cu2+O-).
Оксиды металлов обладают разными свойствами и широко применяются в различных отраслях промышленности. Некоторые оксиды металлов используются в качестве катализаторов, другие - в производстве керамики или стекла, а некоторые служат сырьем для получения других соединений.
Оксид железа (Fe2+O3-) - один из наиболее распространенных оксидов металлов. Он имеет красно-коричневый цвет и применяется в производстве стали и красок. Оксид железа также используется в магнитной ленте для записи информации.
Оксид алюминия (Al3+O2-) - прозрачное соединение, обладающее высокой термической стабильностью. Он используется в производстве электролитических конденсаторов и катализаторов.
Оксид меди (Cu2+O-) - красное соединение, которое обладает проводимостью и используется в электронике для создания полупроводниковых устройств.
В зависимости от степени окисления металла, оксиды металлов могут образовывать различные соединения и иметь разные свойства. Они играют важную роль в химии и промышленности, и их изучение позволяет лучше понять множество процессов и явлений.
Оксиды металлов с примерами
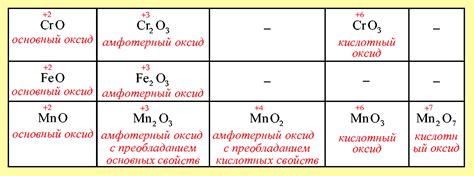
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Некоторые из них являются естественными минералами, а другие имеют важные промышленные применения. Вот несколько примеров оксидов металлов:
- Оксид железа (II) – FeO. Этот оксид, известный также как железная (II) оксид, является черным порошком и используется в производстве железных сплавов, магнитов и катализаторов.
- Оксид железа (III) – Fe2O3. Известный как железный (III) оксид или ржавчина, этот красный порошок применяется для окраски красок, производства стали и в процессе гальванизации.
- Оксид алюминия – Al2O3. Этот белый порошок, известный также как алюминиевый оксид, широко используется в качестве агента против кислотности в лекарствах, в процессе литья металлов и в производстве электрокерамики.
- Оксид магния – MgO. Магниевый оксид, также известный как магния оксид, обладает высокой термической стабильностью и широко применяется в производстве огнеупорных материалов, стекла и сельскохозяйственных удобрений.
- Оксид цинка – ZnO. Цинковый оксид, известный также как цинковый белый, используется в производстве лекарственных препаратов, солнцезащитных кремов, косметической продукции и лаков.
Это только некоторые примеры оксидов металлов. В природе и в промышленности существует множество других соединений, которые играют важную роль в различных областях науки и техники.
Формулы основных оксидов металлов
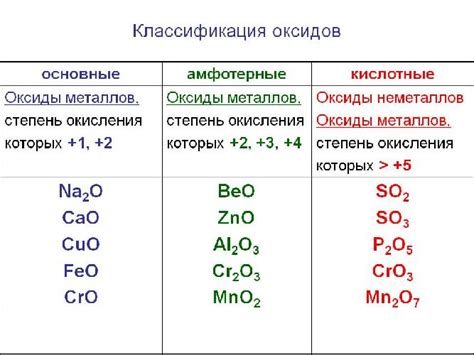
Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Эти соединения обладают различными свойствами и играют важную роль в химических реакциях и промышленных процессах. В таблице ниже приведены формулы основных оксидов некоторых металлов.
| Металл | Формула оксида |
|---|---|
| Железо | Fe2O3 |
| Медь | CuO |
| Алюминий | Al2O3 |
| Свинец | PbO |
| Цинк | ZnO |
Оксиды металлов могут быть кислыми, основными или амфотерными, в зависимости от своего химического поведения. Основные оксиды обладают щелочными свойствами и реагируют с кислотами, образуя соли и воду. Они широко используются в производстве стекла, керамики, электротехнических материалов и других промышленных приложениях.
Изучение оксидов металлов является важным аспектом химической науки и имеет широкий практический интерес. Формулы оксидов металлов позволяют определить их состав и свойства, что в свою очередь позволяет использовать их в различных областях науки и промышленности.
Оксиды типа попериодических оксидов
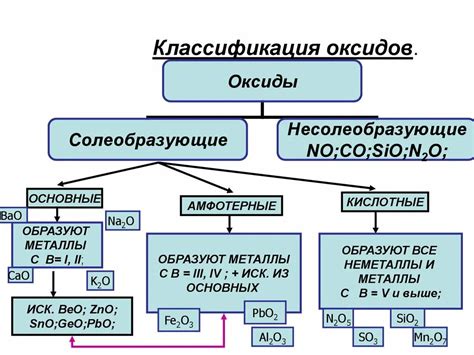
Оксиды типа попериодических оксидов представляют собой соединения, в которых кислород имеет отрицательную степень окисления. В таких соединениях кислород соединяется с металлами различных групп и подгрупп периодической системы. Формула оксида состоит из символа металла и символа кислорода.
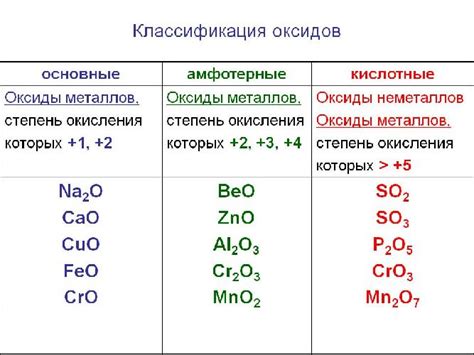
Оксиды типа попериодических оксидов можно разделить на несколько классов. К первому классу относятся основные оксиды, которые образуются при соединении металла с кислородом. Они обладают щелочными свойствами и способны образовывать гидроксиды при реакции с водой. Примерами основных оксидов являются оксид натрия (Na2O) и оксид кальция (CaO).
Ко второму классу относятся кислые оксиды, которые образуются при соединении неметалла с кислородом. Они обладают кислотными свойствами и способны образовывать кислоты при растворении в воде. Примерами кислых оксидов являются оксид серы (SO2) и оксид углерода (CO2).
Третий класс оксидов типа попериодических оксидов - это амфотерные оксиды. Они обладают как щелочными, так и кислотными свойствами. При реакции с щелочью образуют соли, а при реакции с кислотой образуют соли кислот. Примером амфотерного оксида является оксид алюминия (Al2O3).
Оксиды валентного типа
Оксиды валентного типа - это соединения металла с кислородом, в которых валентность металла превышает его валентность в соединении с кислородом степени редокс-системы.
Такие оксиды образуются при образовании соединений с известной окислительной способностью металла. Примерами таких оксидов являются многочисленные соединения металлов с оскислителями группы II и ІV.
Оксиды валентного типа можно представить в виде таблицы, где указана формула и обозначение для каждого соединения:
| Формула | Обозначение |
|---|---|
| Fe3+O4 | Магнитное железо(II,III)оксид |
| CrO2 | Хром(II)оксид |
| MnO2 | Двуокись марганца |
Одной из особенностей оксидов валентного типа является возможность эквивалентного замещения их в соединениях с другими элементами. Например, магнитное железо(II,III)оксид может быть замещен другим железом или другими металлами.
Оксиды валентного типа имеют широкое применение в различных областях, включая производство керамики, электронику, катализ и другие отрасли промышленности.
Оксиды с кислотными свойствами
Оксиды с кислотными свойствами - это соединения, которые взаимодействуют с водой и образуют кислоты. В таких соединениях кислород имеет отрицательный заряд и может отдавать протоны. Они являются кислотными оксидами.
Один из примеров оксидов с кислотными свойствами - оксид сернистого ангидрида (SO2). При растворении в воде образуется серный диоксид, который реагирует с водой, образуя сульфаты с диоксидом серы и сероводородом.
Еще одним примером оксида с кислотными свойствами является оксид серы VI (SO3). При смешении с водой образуется сульфатная кислота (гидрид серы VI), которая обладает сильными кислотными свойствами.
Оксид фосфора V (P2O5) - еще один пример вещества с кислотными свойствами. При контакте с водой образуется фосфорная кислота (H3PO4), которая содержит кислород и фосфор, имеет кислотные свойства и используется в различных отраслях промышленности.
Оксиды с кислотными свойствами - это важные соединения, которые находят широкое применение в химической промышленности и в науке. Они обладают химически активными свойствами и играют важную роль в различных реакциях и процессах.
Оксиды с основными свойствами
Оксиды металлов являются соединениями металлов с кислородом. В зависимости от типа металла и его окислительной способности, оксиды металлов могут обладать различными свойствами. В данной статье рассмотрим оксиды, которые проявляют основные свойства.
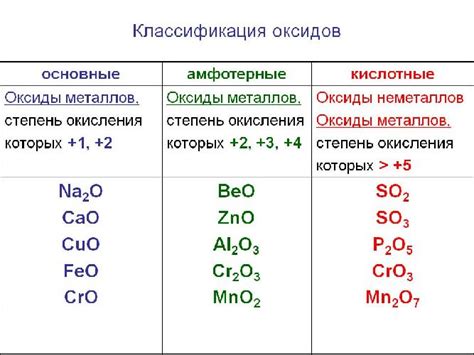
Одним из основных свойств оксидов металлов является их щелочность. Эти соединения могут образовывать гидроксиды при взаимодействии с водой. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH). Гидроксиды металлов обычно обладают щелочными свойствами и используются в химической промышленности и бытовых целях.
Оксиды с основными свойствами также могут отображать свойства амфотерности. Амфотерные оксиды могут проявлять и кислотные, и щелочные свойства в зависимости от условий реакции. Они могут реагировать как с кислотами, так и с щелочами. Примером такого оксида является алюминиевый оксид (Al2O3), который может реагировать как сильнокислотными веществами, так и сильнощелочными веществами.
Оксиды с основными свойствами могут использоваться в различных сферах жизни. Например, оксид известковый (CaO) применяется в производстве цемента и сырья для стекольной промышленности. Оксид кальция (CaO) широко используется также в сельском хозяйстве как известь для орошения почвы и улучшения ее плодородия.
В заключение, оксиды металлов с основными свойствами обладают щелочностью и могут проявлять амфотерность в зависимости от условий реакции. Они находят широкое применение в различных областях, включая производство материалов, сельское хозяйство и химическую промышленность.
Вопрос-ответ

Какие виды оксидов металлов существуют?
Существуют различные виды оксидов металлов, такие как двуокиси, трехокиси, олигомерные и полимерные оксиды.
Можете привести примеры оксидов металлов?
Да, конечно! Некоторыми примерами оксидов металлов являются оксиды таких металлов, как кислород, гидроксид натрия, железо, алюминий и так далее.
Какие свойства имеют оксиды металлов?
Оксиды металлов обладают различными свойствами, включая кислотность, основность и нейтральность. Любопытно, что некоторые оксиды металлов являются амфотерными и могут реагировать как с кислотами, так и с основаниями.
А каково назначение оксидов металлов?
Оксиды металлов имеют различные назначения в различных областях. Например, они используются в качестве катализаторов в химической промышленности, для получения цветных пигментов в керамике и стекле, а также как полупроводниковые материалы в электронике.
Какова роль оксидов металлов в живой природе?
В природе оксиды металлов также играют значимую роль. Некоторые оксиды металлов, такие как магнезия и кальция, являются необходимыми для здоровья человека и животных, а другие оксиды металлов используются в процессах, связанных с дыханием, метаболизмом и ростом.
