Интересным фактом является то, что не все металлы одинаково реагируют с водой. Некоторые металлы могут реагировать с водой так интенсивно, что их нельзя держать в открытом виде, в то время как другие металлы могут совсем не реагировать или реагировать очень медленно.
Наиболее известными металлами, которые быстро реагируют с водой, являются щелочные металлы, такие как литий, натрий и калий. При контакте с водой они производят газообразный водород и образуют щелочные гидроксиды. Эта реакция очень интенсивна и может привести к вспышке или даже взрыву, особенно если металл находится в виде порошка или тонкой фольги.
Следующими по скорости реакции с водой являются некоторые щелочноземельные металлы, такие как магний и кальций. Они также производят газообразный водород, но их реакция протекает более медленно и контролируемо. Например, магний можно использовать для создания огнетушителей на основе порошка, так как он реагирует с водой и гасит пламя.
Остальные металлы, включая железо, алюминий и цинк, обычно реагируют с водой очень медленно или вовсе не реагируют. Они могут покрыться тонким слоем оксида, который предотвращает их дальнейшую реакцию с водой. Если этот слой оксида был удален, то эти металлы могут начать реагировать с водой, но сравнительно медленно.
Таким образом, скорость реакции металлов с водой зависит от их свойств и позиции в периодической системе элементов. Щелочные металлы, такие как литий, натрий и калий, реагируют с водой очень интенсивно, щелочноземельные металлы, такие как магний и кальций, реагируют медленнее, а остальные металлы обычно не реагируют с водой или реагируют очень медленно.
Самые активные металлы
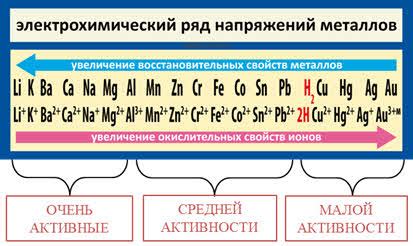
Активность металлов обусловлена их способностью реагировать с другими веществами. Взаимодействие металла с водой может протекать с выделением водорода и образованием гидроксидов металла. Некоторые металлы обладают особенно высокой активностью в этом отношении и реагируют с водой очень быстро.
Наиболее активными металлами являются щелочные металлы - литий, натрий, калий, рубидий, цезий. Они быстро вступают в реакцию с водой, выделяя горючий водородный газ и образуя щелочные гидроксиды. Реакция протекает настолько интенсивно, что металл может расти и двигаться по поверхности воды. Эта особенность широко используется при демонстрации реакции металлов с водой в химическом образовании.
Также к активным металлам относятся щелочноземельные металлы - магний, кальций, барий, стронций. Они не такие реактивные, как щелочные металлы, но все же способны взаимодействовать с водой при высокой температуре или при наличии катализатора. Реакция этих металлов с водой происходит с выделением водорода и образованием гидроксида металла.
Таким образом, самые активные металлы, которые быстрее реагируют с водой, включают в себя щелочные металлы - литий, натрий, калий, рубидий, цезий, а также щелочноземельные металлы - магний, кальций, барий, стронций. Их высокая активность обусловлена их электрохимическими свойствами и позволяет использовать их в различных химических процессах.
Литий

Литий - это химический элемент с символом Li. Он относится к щелочным металлам и является наименее плотным из всех металлов. Литий имеет атомный номер 3 и отличается от других металлов своей очень низкой плотностью и высокой реактивностью.
Литий очень быстро реагирует с водой. При контакте с водой молекулы лития реагируют с молекулами воды, образуя гидроксид лития (LiOH) и высвобождая водород (H2) в газообразном состоянии. Реакция происходит очень быстро и является очень экзотермической, то есть выделяется большое количество тепла.
Мощная реакция лития с водой делает его опасным для обычного использования. При контакте с водой литий может выделяться в виде плавающих шариков, которые могут воспламениться и вызвать пожар или взрыв. Поэтому при работе с литием необходимо соблюдать предосторожность и использовать специальные методы обращения.
Литий широко используется в различных областях, включая производство легких аккумуляторных батарей, создание сплавов для аэрокосмической промышленности и производство лекарственных средств. Благодаря своим уникальным химическим свойствам, литий играет важную роль в современной науке и технологиях.
Калий

Калий — это химический элемент с атомным номером 19. Он относится к алкалийным металлам, которые имеют высокую активность и реактивность. Калий обладает серебристо-белым металлическим блеском и мягкостью. Он является одним из самых реактивных металлов при контакте с водой.
Взаимодействие калия с водой происходит с выделением водорода и образованием гидроксида калия. Реакция проходит при образовании яркой пламенной вспышки. Калий реагирует с водой достаточно интенсивно, способен даже взорваться при контакте с небольшим количеством воды.
Помимо взаимодействия с водой, калий может реагировать с кислородом в воздухе, образуя оксид калия. Кроме того, калий может выделяться из своих соединений при нагревании или взаимодействии с другими реагентами.
Калий широко применяется в различных отраслях, включая химическую промышленность, сельское хозяйство, металлургию и др. Он используется для производства удобрений, стекла, синтетических пластиков, а также в процессах получения некоторых органических соединений.
Натрий

Натрий - это активный металл, который быстро реагирует с водой. При контакте с водой натрий инициирует химическую реакцию, из-за которой происходит образование водорода и образуется раствор щелочи.
Реакция натрия с водой происходит по следующей схеме:
- Вначале натрий образует оксид натрия (Na2O), взаимодействуя с молекулами воды.
- Затем оксид натрия реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя молекулы водорода (H2).
Реакция натрия с водой является очень бурной и может сопровождаться выделением значительного количества тепла и пламени. Поэтому необходимо обращать особое внимание на безопасность при работе с натрием.
Образующийся гидроксид натрия является щелочным раствором и способен гореть глазки на коже и слизистых. При попадании на кожу или в глаза рекомендуется немедленно промыть водой и обратиться за медицинской помощью.
| Реактанты | Продукты |
|---|---|
| 2Na | 2NaOH + H2 |
Металлы средней активности

Металлы средней активности — это металлы, которые реагируют с водой, но не так быстро и не так сильно, как активные металлы. Такие металлы встречаются в периодической системе элементов в периодах с 3 по 5.
Одним из примеров металлов средней активности является алюминий. При контакте с водой алюминий образует оксидную пленку, которая препятствует дальнейшей реакции с водой. Однако, если алюминий находится в порошкообразном состоянии, реакция с водой может протекать более интенсивно.
Другим примером металла средней активности является цинк. При взаимодействии с водой он образует гидроксид цинка и выделяет водород. Реакция цинка с водой является неравновесной и протекает с умеренной скоростью. В результате реакции цинка с водой образуется раствор соли цинка, который может быть использован в различных промышленных процессах.
Еще одним примером металла средней активности является свинец. При контакте с водой свинец образует плотную оксидную пленку, которая предотвращает дальнейшую реакцию с водой. Однако, свинец может реагировать с кислотами, образуя соли свинца.
В целом, металлы средней активности обладают умеренной реактивностью при контакте с водой. Они образуют оксидные пленки или гидроксиды, которые защищают металл от дальнейшего взаимодействия с водой, но при определенных условиях реакция может протекать более интенсивно.
Магний

Магний - химический элемент, принадлежащий к группе щелочноземельных металлов. Он характеризуется серебристо-белым цветом и является легким и достаточно пластичным металлом. Он активно реагирует с водой, образуя гидроксид магния и водородный газ.
За счет своей относительно высокой реактивности, магний используется в различных областях. Он широко применяется в производстве сплавов для авиационной и автомобильной промышленности, а также в производстве прочных и легких металлических конструкций.
Однако, стоит отметить, что реакция магния с водой является сравнительно медленной и незначительной по сравнению с некоторыми другими металлами. Например, литий, натрий и калий реагируют с водой значительно более интенсивно.
В целом, магний является важным элементом, который находит применение в различных отраслях промышленности и обладает интересными химическими свойствами, включая его реакцию с водой.
Цинк

Цинк – химический элемент из группы переходных металлов, который активно взаимодействует с водой. Реакция цинка с водой протекает с выделением водорода и образованием ослабленного раствора гидроксида цинка.
Цинк является одним из самых активных металлов, взаимодействующих с водой. При этом реакция происходит достаточно медленно, что позволяет контролировать процесс и предотвращает слишком быстрый разрыв реакционной среды.
При взаимодействии с водой цинк образует гидроксид цинка (Zn(OH)2), который не растворяется в воде и образует белую пропитку на поверхности металла. Постепенное растворение цинка и осаждение гидроксида на его поверхности ведёт к образованию защитной пленки, которая предотвращает дальнейшую реакцию с водой и обеспечивает стабильность металла в агрессивной среде.
Реакция цинка с водой протекает в соответствии с химическим уравнением: Zn + 2H2O → Zn(OH)2 + H2.
Из-за своей активности и защитной пленки, цинк широко используется в различных областях. Он применяется в гальванической промышленности, в строительстве, в производстве абразивов и некоторых лекарственных препаратов.
Железо

Железо является одним из основных металлов, которые могут реагировать с водой. Взаимодействие железа с водой зависит от различных факторов, таких как температура, чистота воды и наличие кислорода. Железо способно реагировать как с холодной, так и с горячей водой, но скорость реакции будет отличаться.
Реакция железа с водой осуществляется в два этапа. Сначала происходит окисление железа, в результате которого образуется растворимое железное соединение. Затем происходит реакция воды с образовавшимся соединением, образуя водород и гидроксид железа.
Скорость реакции железа с водой зависит от поверхности металла, поэтому часто исследования проводятся с помощью железных стружек или порошка. При взаимодействии с холодной водой, реакция может быть медленной и продолжаться в течение нескольких часов. Однако при использовании горячей воды реакция происходит значительно быстрее.
Реакция железа с водой может быть усилина или замедлена в зависимости от условий эксперимента. Например, добавление кислорода или кислоты может ускорить процесс, а наличие пленки оксида на поверхности железа может замедлить реакцию.
Изучение реакции железа с водой имеет практическое значение. Например, реакция железа с водой является одной из причин коррозии железных предметов. Кроме того, это может быть полезно при производстве водорода или при создании генераторов водорода.
Наименее активные металлы
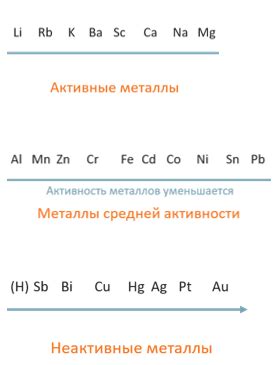
Великая часть металлов активно взаимодействует с водой, образуя различные реакции. Однако существуют и наименее активные металлы, которые взаимодействуют с водой гораздо медленнее или практически не реагируют с ней.
Один из таких металлов - золото (Au). Этот благородный металл известен своей устойчивостью к окружающей среде и неизменной яркой желтой окраске. Однако при определенных условиях золото может претерпеть различные реакции. С контактом с водой, золото не реагирует активно и медленно окисляется воздухом. Это делает его одним из наименее активных металлов в отношении воды.
Еще одним наименее активным металлом является серебро (Ag). Серебро обладает высокой электропроводностью и хорошо сопротивляется коррозии. Оно может взаимодействовать с водой при высоких температурах, но обычно не реагирует с ней при комнатной температуре. Поэтому серебро также считается наименее активным металлом относительно воды.
Также, можно отметить платину (Pt) как еще один наименее активный металл по отношению к воде. Платина обладает высокой коррозионной устойчивостью и не реагирует с водой в обычных условиях. Однако при более высоких температурах, платина может начать взаимодействовать с водой.
Таким образом, золото, серебро и платина являются наименее активными металлами по отношению к воде. Их устойчивость к взаимодействию с водой делает их ценными материалами в различных промышленных и научных областях.
Алюминий

Алюминий (Al) – легкий, химически активный металл, который относится к группе бледных металлов в периодической системе. Он имеет серебристый цвет и хорошую проводимость тепла и электричества. Алюминий также известен своей низкой плотностью и высокой прочностью, что делает его незаменимым материалом во многих областях промышленности.
Реакция алюминия с водой
Алюминий реагирует с водой, но реакция протекает медленно и неполно. На поверхности металла образуется оксидная пленка, которая препятствует дальнейшей реакции. Однако, в присутствии щелочей, таких как натрий или калий, реакция алюминия с водой ускоряется.
Взаимодействие алюминия с водой при нагревании
При нагревании алюминиевой фольги или стружки в воде происходит более интенсивная реакция. При этом образуется гидроксид алюминия и выделяется гидрогений. Реакция также выполняется с выделением большого количества тепла.
- Алюминий является одним из самых распространенных металлов в земной коре.
- Он широко используется в промышленности для производства автомобилей, кухонной утвари, упаковочных материалов и других товаров.
- Алюминий также активно применяется в строительстве, благодаря своей легкости и прочности.
Вопрос-ответ

Какие металлы реагируют с водой?
Реагируют с водой такие металлы, как натрий, калий, литий, рубидий, цезий, барий, кальций, стронций и магний.
Почему некоторые металлы реагируют с водой, а другие нет?
Реакция металлов с водой зависит от их химической активности. Металлы, которые реагируют с водой, имеют высокую активность и способны выделять из воды водород. Металлы с низкой активностью не реагируют с водой или реагируют очень медленно.
Какие металлы быстрее реагируют с водой?
Металлы с более низкой позицией в электрохимическом ряду активности реагируют быстрее с водой. Например, натрий и калий реагируют с водой очень быстро, образуя гидроксиды и выделяя водород. Алюминий и цинк тоже реагируют с водой, но намного медленнее.
Какие опасности могут возникнуть при реакции металлов с водой?
Реакция активных металлов с водой может быть опасной из-за выделения водорода, который является горючим газом. Например, натрий реагирует с водой, образуя горючий гидроксид натрия и выделяя водород. В замкнутом пространстве такая реакция может привести к образованию взрывчатой смеси, что может привести к серьёзным авариям.
