Серная кислота (H2SO4) является одним из самых распространенных и важных химических соединений, которое находит широкое применение в различных отраслях промышленности. Взаимодействие этой кислоты с металлами может приводить к образованию сульфатов и выделению водорода.
Список металлов, реагирующих с серной кислотой, включает большое количество элементов, начиная от щелочных металлов таких как натрий (Na) и калий (K), до тяжелых металлов, таких как свинец (Pb) и медь (Cu). При взаимодействии с серной кислотой металлы могут проявлять различные свойства и реакции.
Некоторые металлы, такие как цинк (Zn), реагируют с серной кислотой быстро и интенсивно, с выделением пузырей газа водорода (H2) и образованием сульфата цинка (ZnSO4). Другие металлы, например алюминий (Al), медленнее реагируют с серной кислотой, образуя сульфат алюминия (Al2(SO4)3) и выделяя водород.
Металлы, реагирующие с серной кислотой: таблица

Список металлов, которые проявляют реакцию с серной кислотой, включает в себя несколько элементов. Серная кислота (H2SO4) является одной из сильных кислот и способна реагировать с различными металлами.
Среди металлов, которые реагируют с серной кислотой, можно отметить: железо (Fe), цинк (Zn), медь (Cu), магний (Mg), алюминий (Al) и свинец (Pb). Реакция металла с серной кислотой приводит к образованию солей и выделению водорода (H2).
Например, когда железо реагирует с серной кислотой, образуется сульфат железа (FeSO4) и выделяется водород. Подобным образом, цинк, медь, магний и алюминий также образуют соответствующие соли с серной кислотой.
Однако, не все металлы реагируют с серной кислотой. Например, серебро (Ag), золото (Au) и платина (Pt) не реагируют с ней. Это связано с их высокой устойчивостью к химическим реакциям.
Важно помнить, что реакция металла с серной кислотой может проходить с разной интенсивностью в зависимости от концентрации кислоты и времени взаимодействия. Также стоит учитывать безопасность при работе с серной кислотой, так как она является коррозионно активным веществом.
В таблице ниже приведен список металлов, реагирующих с серной кислотой, и их химические формулы соляных соединений:
| Металл | Химическая формула соли |
|---|---|
| Железо (Fe) | FeSO4 |
| Цинк (Zn) | ZnSO4 |
| Медь (Cu) | CuSO4 |
| Магний (Mg) | MgSO4 |
| Алюминий (Al) | Al2(SO4)3 |
| Свинец (Pb) | PbSO4 |
Эта таблица позволяет легко увидеть связь между металлами и солями, которые образуются при их реакции с серной кислотой.
Щелочные металлы

Щелочные металлы - это химические элементы, относящиеся к первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой химической активностью и реагируют с различными веществами, включая серную кислоту.
Реакция щелочных металлов с серной кислотой происходит с образованием солей серной кислоты и выделением водорода. Например, реакция лития с серной кислотой приводит к образованию сульфата лития (Li2SO4) и выделению водорода:
- 2Li + H2SO4 → Li2SO4 + H2↑
Подобные реакции наблюдаются и с другими щелочными металлами. Например, реакция натрия с серной кислотой приводит к образованию сульфата натрия (Na2SO4) и выделению водорода:
- 2Na + H2SO4 → Na2SO4 + H2↑
Щелочные металлы являются сильными восстановителями и обладают высокой электроотрицательностью. Они образуют щелочные гидроксиды, растворимые в воде, и легко реагируют с кислотами, включая серную кислоту. Реакция щелочных металлов с серной кислотой является одной из простых и широко изученных реакций в химии.
Металлы 1-й группы

Металлы 1-й группы — это элементы периодической таблицы, которые находятся в первом вертикальном ряду. В данной группе располагаются такие металлы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы весьма активны и легко образуют положительные ионы.
Металлы 1-й группы характеризуются высокой реактивностью, особенно в контакте с водой. Они образуют гидроксиды, которые обладают щелочными свойствами. Также они реагируют с кислотами, в том числе с серной кислотой.
Серная кислота (H2SO4) является сильной кислотой и обладает высокой степенью остеатической активности. Взаимодействие металлов 1-й группы с серной кислотой протекает следующим образом: образование соответствующих соляных соединений и выделение серной кислоты. Процесс реакции можно представить следующим образом:
- Взаимодействие металла 1-й группы с серной кислотой приводит к образованию соли и выделению водорода.
- Соли, полученные в результате данной реакции, являются сернистыми солями или сульфатами металлов 1-й группы.
- Водород, выделенный при реакции, является горючим газом и может возгореться, если его зажечь.
Таким образом, металлы 1-й группы реагируют с серной кислотой, образуя соли и выделяя водород. Эти реакции характерны для данной группы металлов и имеют большое практическое значение.
Металлы 2-й группы
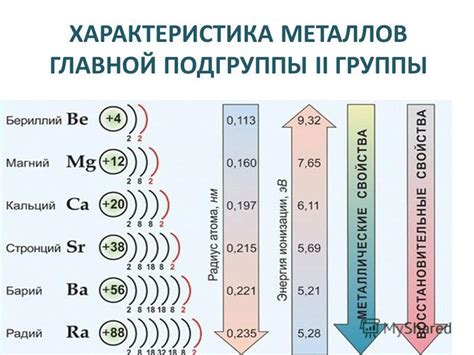
Металлы 2-й группы – это элементы, которые характеризуются устойчивым положительным окислением в соединениях и образованием двух зарядов, равных 2+ и 1+. В таблице Менделеева эти металлы расположены в первом периоде после щелочноземельных металлов и включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Основное свойство металлов 2-й группы – их активность в химических реакциях. Они образуют щелочные оксиды и гидроксиды, которые растворяются в воде с образованием щелочных растворов. Кроме того, они реагируют с кислотами, образуя соли и выделяя водород.
Реакция металлов 2-й группы с серной кислотой также характеризуется выделением водорода. При этом образуется сульфат металла и вода. Например, реакция магния с серной кислотой выглядит так: Mg + H2SO4 → MgSO4 + H2O + SO2. Подобные реакции с серной кислотой происходят и с другими металлами 2-й группы.
Таким образом, металлы 2-й группы являются активными химическими элементами, образующими соли с серной кислотой и выделяющими водород. Изучение их свойств позволяет более глубоко понять процессы, происходящие в химических реакциях и применять данные знания в практике.
Металлы 3-й группы

Металлы 3-й группы периодической системы Менделеева включают такие элементы, как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Все они являются щелочноземельными металлами. Несмотря на то, что металлы 3-й группы не обладают высокой реактивностью, они все же способны реагировать с серной кислотой.
Бериллий (Be) является самым легким металлом 3-й группы. При взаимодействии с серной кислотой образуется сульфат бериллия и выделяется сернистый газ:
Be + H2SO4 → BeSO4 + H2S
Магний (Mg) также реагирует с серной кислотой с образованием сульфата магния и выделением сернистого газа:
Mg + H2SO4 → MgSO4 + H2S
Кальций (Ca) реагирует еще активнее с серной кислотой. При взаимодействии образуется сульфат кальция и выделяется сернистый газ:
Ca + H2SO4 → CaSO4 + H2S
Стронций (Sr), барий (Ba) и радий (Ra) также реагируют с серной кислотой, образуя соответствующие сульфаты и выделяя сернистый газ.
Полуметаллы
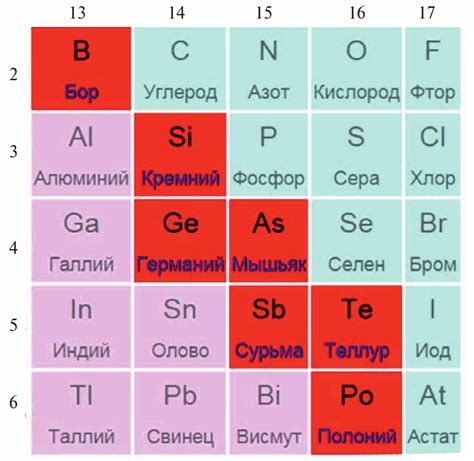
Полуметаллы — это группа элементов, обладающих свойствами как металлов, так и неметаллов. Их химические свойства варьируются в зависимости от условий и окружающей среды, что делает их уникальными и полезными в различных отраслях науки и промышленности.
Одним из самых известных представителей полуметаллов является германий. Он обладает электропроводностью, но при этом имеет некоторые неметаллические свойства, такие как хрупкость и слабую теплопроводность. Главным образом германий используется в электронике, в частности, при создании полупроводниковых приборов.
Другим полуметаллом является бор. Он обладает металлическим блеском, но при этом имеет низкую теплопроводность и высокую твердость. Бор используется во многих областях, включая производство стекла, керамики и лекарственных препаратов.
Антивмон, еще один полуметалл, не обладает полностью металлическими свойствами. Он обладает высокой проводимостью электричества, но при этом хрупок и не имеет блеска металла. Антивмон используется в различных отраслях, включая производство аккумуляторов и полупроводниковых устройств.
Полуметаллы представляют интерес для научных исследований и инженерии в силу своих уникальных свойств. Их использование в различных отраслях способствует развитию новых технологий и материалов.
Переходные металлы

Переходные металлы - это элементы из блока d периодической таблицы, которые имеют отличные от синтетических строение и свойства. Они являются химически активными и способны образовывать разнообразные соединения.
Переходные металлы обладают разнообразными окрасками, что делает их популярными для использования в качестве красителей, пигментов и катализаторов. Они часто образуют стойкие цветные соединения, такие как соли и оксиды.
Элементы блока d образуют стабильные соединения с серной кислотой. Они реагируют с серной кислотой, образуя сульфаты. Некоторые из популярных переходных металлов, которые реагируют с серной кислотой, включают железо, медь, никель и цинк.
Железо является одним из наиболее распространенных переходных металлов. Оно реагирует с серной кислотой, образуя сульфат железа(II) и выделяя диоксид серы и воду в виде побочных продуктов реакции.
Медь также образует сульфат в реакции с серной кислотой. Однако, в этой реакции может образоваться два вида сульфата - сульфат меди(II) и сульфат меди(II) гидрат, в зависимости от условий реакции.
Пассивированный никель реагирует с концентрированной серной кислотой, образуя никелевый сульфат и оксиды серы в качестве побочных продуктов. Эта реакция особенно полезна в промышленности при очистке металлических поверхностей от загрязнений.
Цинк, как и другие переходные металлы, также реагирует с серной кислотой. Реакция приводит к образованию сульфата цинка и выделению газа - диоксида серы. Цинк используется в различных промышленных процессах, таких как гальванизация и производство батарей.
Металлы блока p

Металлы блока p, или по другому называемые пост-переходные или полупереходные элементы, являются химически активными металлами, расположенными в третьем и четвертом периодах в таблице периодических элементов. В этом блоке находятся такие элементы, как бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl), свинец (Pb) и бисмут (Bi).
Металлы блока p характеризуются хорошей электропроводностью, благодаря своим свободным электронам. Они также обладают химической реактивностью и могут образовывать разнообразные соединения с другими элементами. Например, алюминий (Al) широко используется в производстве легких конструкций, благодаря своей легкости и прочности. Бисмут (Bi) является одним из наиболее плотных металлов и используется в производстве керосиновых двигателей и в биомедицинских исследованиях.
Металлы блока p также могут реагировать с серной кислотой, образуя соли и выделяяся водородный газ. Это связано с их высокой активностью и химической реактивностью. Реакция металлов блока p с серной кислотой может быть представлена следующим уравнением:
| Металл блока p | Уравнение реакции |
| Бор (B) | 2B + 3H2SO4 → B2(SO4)3 + 3H2 |
| Алюминий (Al) | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
| Галлий (Ga) | 2Ga + 3H2SO4 → Ga2(SO4)3 + 3H2 |
| Индий (In) | 2In + 3H2SO4 → In2(SO4)3 + 3H2 |
| Таллий (Tl) | 2Tl + 3H2SO4 → Tl2(SO4)3 + 3H2 |
| Свинец (Pb) | Pb + H2SO4 → PbSO4 + H2 |
| Бисмут (Bi) | Bi + 2H2SO4 → Bi2(SO4)3 + 2H2 |
Вопрос-ответ

Какие металлы реагируют с серной кислотой?
С серной кислотой реагируют многие металлы, включая алюминий, медь, цинк, железо, свинец, серебро и другие.
Как происходит реакция между металлами и серной кислотой?
В реакции между металлами и серной кислотой образуется соль и выделяется водородный газ. Например, железо реагирует с серной кислотой по следующему уравнению: Fe + H2SO4 = FeSO4 + H2. Таким образом, металл замещает водород и образует соединение с серной кислотой.
