Валентность – это свойство атомов составлять химические связи с другими атомами. Изучение валентности является одним из основных аспектов химии, поскольку позволяет понять, каким образом происходят реакции между различными веществами. Валентность определяется числом элементарных частиц, которые атом вещества принимает (отдает) при образовании химической связи.
Особый интерес представляет валентность при реакциях металлов с неметаллами. Правило валентности металлами с неметаллами указывает на способ определения валентности металла в соединении. Согласно этому правилу, валентность металла и неметалла в соединении определяется таким образом, чтобы общий положительный заряд металла и отрицательный заряд неметалла были равными. Такой принцип позволяет более просто определить валентность металла в соединении и предсказать результат реакции.
Рассмотрим несколько примеров реакций между металлами и неметаллами. Например, реакция между кислородом и металлом натрием. Исходя из правила валентности, натрий имеет валентность +1, а кислород –2. Чтобы общий положительный заряд натрия и отрицательный заряд кислорода сравнялись, в реакции участвует два атома натрия и один атом кислорода. Таким образом, получается соединение Na2O – едкое вещество натрия.
Валентность металлов и неметаллов

Валентность металлов и неметаллов - это показатель способности атомов данных элементов образовывать химические связи с другими атомами. Она определяет, сколько электронов может металл или неметалл передать или принять при образовании химической связи. Валентность играет важную роль в определении физических и химических свойств веществ.
Металлы, как правило, имеют положительную валентность и могут передавать электроны во время реакций. Они обычно образуют ион положительного заряда, который становится катионом. Например, медь (Cu) имеет валентность 1 и может образовать ион Cu+, передавая один электрон.
Неметаллы, в свою очередь, имеют отрицательную валентность и способны принимать электроны от других элементов. Они образуют анион отрицательного заряда. Например, кислород (O) имеет валентность 2 и может образовать ион O2-, принимая два электрона.
Сочетание металла и неметалла в химической реакции может привести к образованию ионного соединения, в котором металл отдает электроны неметаллу. Например, при реакции натрия (Na) с хлором (Cl) образуется хлорид натрия (NaCl), где натрий передает один электрон, а хлор принимает его.
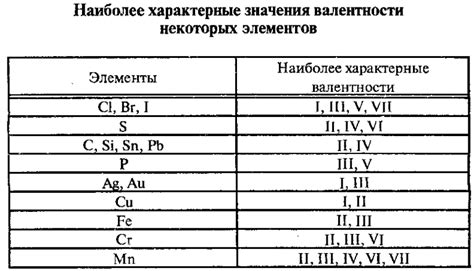
Однако у некоторых металлов и неметаллов может быть несколько вариантов валентности, что связано с изменением количества передаваемых или принимаемых электронов. Например, железо (Fe) может иметь валентность 2+ или 3+, а кислород может иметь валентность 2- или 1-. Такие элементы могут образовывать различные соединения в зависимости от валентности.
Основные положения правила валентности
Правило валентности является основным принципом, описывающим химические реакции между металлами и неметаллами. Оно указывает на возможные степени окисления металлов и валентности неметаллов, которые участвуют в образовании химических соединений.
Правило валентности основывается на том факте, что в химическом соединении сумма степеней окисления всех элементов должна быть равна нулю. Степень окисления металла определяется как число, обозначающее, сколько электронов металл отдал или принял в результате образования соединения. Валентность неметалла указывает на число электронов, которые неметалл способен принять или отдать при образовании соединения.
Правило валентности позволяет определить, какой металл и какой неметалл способны образовывать стабильные химические связи. Например, натрий, имеющий степень окисления +1, может образовывать соединения с неметаллами, у которых валентность -1, такими как хлор или фтор. В результате образуется хлорид натрия или фторид натрия.
Правило валентности также позволяет предсказать, какой тип химической связи будет образовываться между металлом и неметаллом. Если металл имеет степень окисления, меньшую чем его валентность, образуется ионная связь, так как металл отдает электроны неметаллу. Если металл имеет степень окисления, большую чем его валентность, образуется координационная связь, так как металл принимает электроны от неметалла.
Применение правила валентности позволяет более точно предсказать химические реакции и определить структуру химических соединений между металлами и неметаллами.
Правило валентности в примерах реакций

Правило валентности металлами с неметаллами является основополагающим для понимания химических реакций. В соответствии с этим правилом, металлы имеют положительную валентность, а неметаллы – отрицательную.
Примером реакции, соответствующей правилу валентности, является реакция между натрием и хлором. Натрий имеет валентность +1, а хлор –1. В результате реакции образуется хлорид натрия:
2Na + Cl2 → 2NaCl
При этом натрий отдает один электрон хлору, чтобы оба элемента достигли квазиинертной конфигурации.
Еще один пример реакции, подчиняющийся правилу валентности, – реакция между магнием и кислородом. Магний имеет валентность +2, а кислород –2. Результатом реакции является оксид магния:
2Mg + O2 → 2MgO
Магний отдает два электрона кислороду, образуя ион Mg2+, а кислород получает эти электроны, образуя ион O2-.
Таким образом, правило валентности металлами с неметаллами объясняет образование ионных связей и позволяет определить заряды ионов в соединениях. Знание этого правила является важным для понимания химических реакций и составления уравнений.
Реакция металлов с кислородом

Одной из важных реакций металлов с неметаллами является их реакция с кислородом. Кислород считается одним из самых активных неметаллов и может вступать в реакцию с большинством металлов.
При взаимодействии с кислородом, металлы образуют соответствующие оксиды. Оксиды металлов обычно являются твердыми веществами с определенной кристаллической структурой и могут иметь различные цвета.
Реакция металлов с кислородом обычно сопровождается выделением тепла и света. Например, при сгорании железа в кислороде образуются искры и образуется оксид железа(III), который имеет красновато-коричневый цвет.
Оксиды металлов, полученные в результате их реакции с кислородом, могут использоваться в различных отраслях промышленности и науки. Например, оксид алюминия, получаемый при сгорании алюминия в кислороде, используется в производстве покрытий для защиты от коррозии и в качестве катализатора в химических процессах.
Реакция металлов с кислородом также может происходить под воздействием высоких температур. Например, при нагревании меди в присутствии кислорода происходит образование оксида меди(II), который имеет черный цвет и применяется в производстве стекол и электронных компонентов.
Реакция металлов с неметаллами

Реакции металлов с неметаллами являются одним из основных типов химических реакций. В этих реакциях металлы обычно отдают электроны, образуя положительные ионы, а неметаллы получают электроны, образуя отрицательные ионы. Такие реакции происходят при взаимодействии металлов с кислородом, галогенами, серой и другими неметаллами.
К примеру, взаимодействие натрия с кислородом приводит к образованию оксида натрия (Na2O). В этой реакции натрий отдаёт один электрон, образуя положительный ион Na+, а кислород получает этот электрон, образуя отрицательный ион O2-. Образовавшиеся ионы образуют ионную связь.
При взаимодействии металлов с галогенами, например, кальцием и хлором, образуется хлорид кальция (CaCl2). Кальций отдаёт два электрона, образуя положительный ион Ca2+, а хлор получает эти электроны, образуя отрицательные ионы Cl-. По аналогии с реакцией с кислородом, образующиеся ионы образуют ионную связь.
В реакциях металлов с неметаллами также может образовываться солевой комплекс. Например, взаимодействие натрия с серой приводит к образованию сульфида натрия (Na2S). Натрий отдаёт два электрона, образуя положительный ион Na+, а сера получает эти электроны, образуя отрицательные ионы S2-. Однако, в отличие от ионной связи, здесь образуется координационная связь, в которой электронные пары атома неметалла образуют свяжущее звено.
Вопрос-ответ

Почему металл может иметь несколько ионов разной валентности?
Металл может иметь несколько ионов разной валентности из-за разного количества электронов, которые он отдает при образовании ионов. Валентность металла определяется его позицией в периодической системе элементов и может меняться в зависимости от условий. Различные ионы металла с разной валентностью могут образовывать различные соединения и принимать участие в разных реакциях.
