Щелочные металлы, такие как натрий, калий и цезий, обладают высокой реакционной способностью и способны взаимодействовать с различными веществами. Азотная кислота, один из наиболее распространенных неорганических кислот, также поддается воздействию этих металлов.
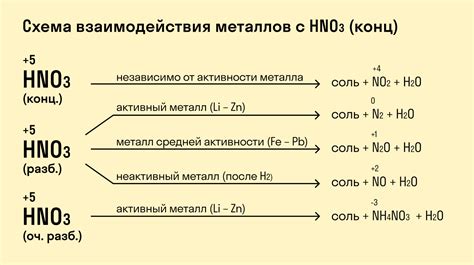
Реакция щелочных металлов с азотной кислотой протекает с выделением газа и образованием солей. В ходе реакции происходит окисление металла и ионизация кислоты. Химическое уравнение реакции содержит коэффициенты, позволяющие соблюдать закон сохранения массы и заряда.
При реакции натрия с азотной кислотой образуется нитрат натрия и оксид азота(I), который является одним из основных продуктов реакции. Эта реакция может быть использована для получения нитратов щелочных металлов, которые находят широкое применение в промышленности и сельском хозяйстве.
Реакции щелочных металлов с азотной кислотой
Реакция щелочных металлов с азотной кислотой является химической реакцией, при которой происходит образование нитратов и выделение газообразного продукта. Азотная кислота, обычно представленная формулой HNO3, является сильным окислителем и может вступать в реакцию с щелочными металлами, такими как натрий (Na), калий (K) и литий (Li).
При вступлении в реакцию с азотной кислотой, щелочные металлы проявляют свою активность и выделяются водород газ (H2). Каждый щелочный металл образует свой нитратный соль: нитрат натрия (NaNO3), нитрат калия (KNO3) или нитрат лития (LiNO3).
Реакция протекает по следующему уравнению:
2M + 8HNO3 → 2MNO3 + 4H2O + N2O4
Где M - щелочный металл.
Такая реакция является экзотермической, то есть выделяется тепло. Также в процессе реакции образуется бурый дым, который представляет собой смесь азотного диоксида (NO2) и диоксида азота (N2O4).
Следует отметить, что щелочные металлы обладают высокой реакционной способностью с азотной кислотой, поэтому при работе с ними необходимо соблюдать предосторожность и использовать защитное снаряжение.
Особенности реакций щелочных металлов с азотной кислотой
Реакция щелочных металлов с азотной кислотой является одной из наиболее химически активных реакций, которая происходит с выделением большого количества тепла.
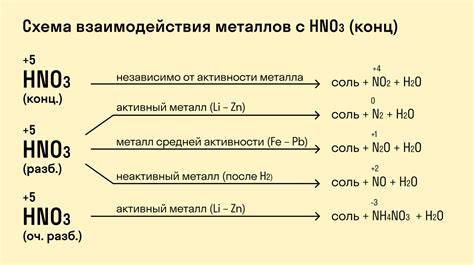
Первой особенностью такой реакции является образование нитратов щелочных металлов. При взаимодействии щелочных металлов (например, натрия или калия) с азотной кислотой происходит образование нитрита этого металла и выделение диоксида азота. Нитраты щелочных металлов обладают высокой растворимостью в воде и имеют широкое применение в различных отраслях промышленности.
Второй особенностью реакции щелочных металлов с азотной кислотой является высокая степень опасности такого взаимодействия. Щелочные металлы, особенно литий, натрий и калий, очень реактивны и при контакте с азотной кислотой могут происходить взрывоопасные реакции. Поэтому при работе с подобными веществами необходимо соблюдать особые меры предосторожности и работать только в хорошо проветриваемых помещениях с использованием средств защиты.
Третьей особенностью реакции щелочных металлов с азотной кислотой является возможность образования аммиака в результате взаимодействия. В некоторых случаях, особенно при высокой концентрации азотной кислоты и низкой температуре, может происходить образование аммиака, который является ядовитым газом. Поэтому при проведении подобных реакций необходимо осторожно контролировать условия проведения и обеспечивать безопасность рабочего места.
Результаты реакции щелочных металлов с азотной кислотой
1. Образование соответствующих солей
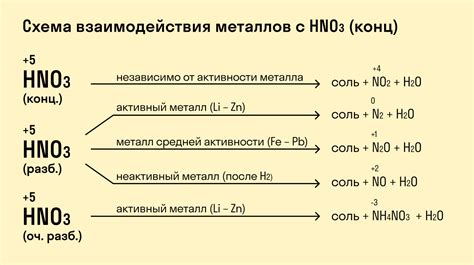
Реакция щелочных металлов, таких как натрий, калий и литий, с азотной кислотой приводит к образованию соответствующих солей. Например, при взаимодействии натрия с азотной кислотой образуется нитрат натрия (NaNO3), при взаимодействии калия - нитрат калия (KNO3), а при взаимодействии лития - нитрат лития (LiNO3).
2. Выделение газа
При реакции щелочных металлов с азотной кислотой также происходит выделение газа - оксида азота (NO) или двуокиси азота (NO2), в зависимости от условий реакции и концентрации азотной кислоты. Это происходит в результате окислительно-восстановительного взаимодействия между азотной кислотой и щелочным металлом.
3. Интенсивное пенение и выпаривание
Во время реакции щелочных металлов с азотной кислотой происходит интенсивное пенение и выпаривание реагентов. Это связано с образованием газа и тепловым эффектом реакции, что приводит к образованию пены и выделению паров кислоты. Этот процесс может быть сопровожден шипением или свистом.
4. Возможность возгорания
При реакции щелочных металлов с азотной кислотой поверхность металла может возгораться или разогреваться, особенно при использовании концентрированной азотной кислоты. Это связано с тем, что азотная кислота является сильным окислителем и способна образовывать взрывоопасные смеси с органическими и неорганическими веществами.
5. Образование аммиака
При реакции щелочных металлов с азотной кислотой также может образовываться аммиак (NH3). Это связано с разложением азотной кислоты под действием высокой температуры или катализатора, который может быть представлен щелочными металлами.
Вопрос-ответ

Какие реакции возникают между щелочными металлами и азотной кислотой?
Реакции щелочных металлов с азотной кислотой приводят к образованию азотных солей и выделению водорода.
Чем обусловлены результаты реакций щелочных металлов с азотной кислотой?
Результаты реакций зависят от активности щелочного металла. Щелочные металлы более активны, чем водород, поэтому они оттягивают его из азотной кислоты, образуя соли и выделяя водород газ.
Какие химические соединения образуются при реакции натрия с азотной кислотой?
При реакции натрия с азотной кислотой образуется нитрат натрия (NaNO3) и выделяется газообразный водород.
Возможно ли провести реакцию лицевого металла с азотной кислотой? Если да, то какие соединения образуются?
Реакция лицевого металла (калия) с азотной кислотой возможна. При этом образуется нитрат калия (KNO3) и выделяется газообразный водород.
Может ли реакция щелочных металлов с азотной кислотой протекать с горением?
Реакция щелочных металлов с азотной кислотой протекает с выделением водорода, но обычно не сопровождается горением, так как водород газ сразу реагирует с кислотой и не воспламеняется.
