Оксиды металлов - это химические соединения, состоящие из металлического и кислородного элементов. Реакция получения оксидов металла - один из основных способов получения этих соединений. Она основана на взаимодействии металлического элемента с кислородом в атмосфере или при воздействии кислорода на металл в специальных условиях.
Процесс получения оксидов металла может происходить как на воздухе при обычной температуре и давлении, так и при повышенных температурах и в условиях горения. В результате реакции металл окисляется, т.е. приобретает положительный заряд, а кислород - редукцию, т.е. приобретает отрицательный заряд.
Например, когда медный провод нагревают, он покрывается тонким слоем медного оксида. Это происходит потому, что медь реагирует с кислородом воздуха при повышенной температуре. В результате реакции образуется медный оксид (CuO).
Реакция получения оксидов металла играет важную роль в различных отраслях производства. Оксиды металлов используются в качестве катализаторов, адрезивов, пигментов, а также в производстве стекла, электроники и других материалов и изделий.
Реакция получения оксидов металла

Оксиды металла – это химические соединения, образующиеся в результате реакции металла с кислородом. Эти соединения широко используются в различных областях науки и техники, так как обладают различными полезными свойствами. Реакция получения оксидов металла основана на окислительно-восстановительной реакции, при которой происходит передача электронов между атомами металла и кислорода.
Процесс получения оксидов металла может происходить в разных условиях. Например, при нагревании металла в присутствии кислорода происходит окисление, что приводит к образованию оксида металла. Также оксиды металла могут образовываться при реакции металла с водой или другими реагентами, содержащими кислород.
Реакции получения оксидов металла важны не только с точки зрения получения этих соединений, но и с точки зрения изучения химических свойств металлов. Оксиды металла имеют различные физические и химические свойства, которые определяют их применение. Некоторые оксиды металла являются катализаторами в химических реакциях, другие – применяются как полупроводники в электронике.
Примеры получения оксидов металла включают реакцию железа с кислородом, при которой образуется оксид железа, и реакцию меди с кислородом, при которой образуется оксид меди. Оба этих оксида металла имеют различные свойства и применяются в разных сферах. Например, оксид железа (III) используется в производстве магнитных материалов, а оксид меди (II) – в производстве электроники.
Основные принципы
Реакция получения оксидов металла является химической реакцией, в результате которой образуется соединение металла с кислородом. Основным принципом реакции является окисление металла, то есть передача электронов от металла к кислороду.
Окисление происходит при взаимодействии металла с кислородом воздуха или с кислородом, содержащимся в химических соединениях. В результате окисления металла образуются оксиды металла, которые характеризуются своими химическими и физическими свойствами.
Основные принципы реакции получения оксидов металла включают следующие этапы: взаимодействие металла с кислородом, образование оксида металла, сохранение массы веществ и энергии.
Примером реакции получения оксидов металла может служить взаимодействие железа с кислородом при нагревании. При этом образуется оксид железа, который имеет химическую формулу Fe2O3. Данная реакция является химическим процессом, который происходит в природе при образовании ржавчины. Оксид железа обладает специфическими свойствами и может использоваться в различных отраслях промышленности.
Примеры реакций

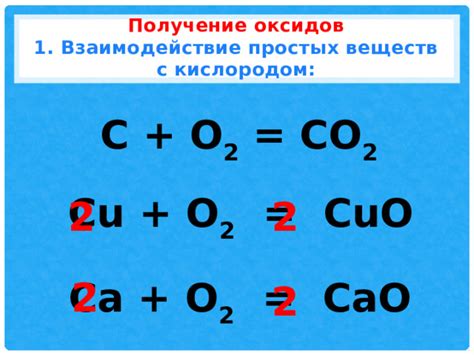
Рассмотрим несколько примеров реакций получения оксидов металлов. Один из наиболее известных примеров - реакция горения магния:
- Магний (Mg) реагирует с кислородом (O2) из воздуха.
- При нагревании магний окисляется до оксида магния (MgO):
- 2Mg + O2 → 2MgO
Другим примером реакции получения оксида является реакция алюминия с кислородом:
- Алюминий (Al) реагирует с кислородом (O2) из воздуха.
- При нагревании алюминий окисляется до оксида алюминия (Al2O3):
- 4Al + 3O2 → 2Al2O3
Еще одной интересной реакцией является получение оксида железа:
- Железо (Fe) реагирует с кислородом (O2):
- При нагревании железо окисляется до оксида железа (Fe2O3):
- 4Fe + 3O2 → 2Fe2O3
Все эти примеры демонстрируют реакцию металла с кислородом, в результате которой образуется соответствующий оксид металла.
Принципы окисления металлов
Окисление металлов – процесс, при котором металл вступает в реакцию с кислородом, образуя оксид. Принципы этого процесса основаны на следующих основных принципах:
- Потенциал окисления металла. Каждый металл обладает своим характерным потенциалом окисления, определяя его способность вступать в окислительно-восстановительные реакции. Металлы с более высоким потенциалом окисления более активно вступают в окислительные реакции, чем металлы с более низким потенциалом окисления.
- Водородное окисление. Многие металлы способны вступать в реакцию с водородом при нагревании, образуя соответствующие оксиды. Этот процесс основан на конкуренции водорода и металла за кислород при образовании оксида.
- Взаимодействие с водой. Некоторые металлы способны взаимодействовать с водой, образуя соответствующие оксиды и высвобождая водород. Этот процесс основан на реакции металла с водой и разделении молекулы воды на кислород и водород.
- Термическое окисление. Металлы могут окисляться при нагревании в присутствии кислорода. При этом происходит активное взаимодействие кислорода с поверхностью металла, образуя оксид.
Применение этих принципов позволяет контролировать процесс окисления металлов и получать разнообразные оксиды для применения в различных отраслях промышленности.
Механизмы окисления металлов

Окисление металлов - это химический процесс, при котором металлы соединяются с кислородом воздуха или другими оксидующими веществами, образуя оксиды. Механизм окисления металлов включает в себя несколько основных шагов.
Первым шагом является контакт металла с оксидующим агентом, который может быть кислородом воздуха, водой или другими веществами. Вторым шагом происходит реакция между металлом и оксидующим агентом, при которой металл отдает электроны, а оксидующий агент их принимает. Этот процесс называется окислением металла.
Третий шаг заключается в образовании оксида металла, когда оксидующий агент и металл соединяются. Образовавшийся оксид металла может иметь различные степени окисления в зависимости от количества электронов, которые металл отдал. Например, медь может образовывать оксиды Cu2O и CuO.
Механизм окисления металлов может варьироваться в зависимости от конкретных условий окисления, таких как температура, присутствие катализаторов и степень чистоты металла. Некоторые металлы могут окисляться очень быстро, тогда как другие могут быть устойчивыми к окислению.
Знание механизмов окисления металлов является важным для многих областей науки и промышленности, таких как коррозия металлов, производство оксидов для использования в качестве пигментов или катализаторов, а также для разработки новых материалов с улучшенными свойствами.
Получение оксидов через реакцию с кислородом
Одним из способов получения оксидов металла является их реакция с кислородом. Когда металл вступает в контакт с кислородом, происходит окисление, в результате которого образуется соответствующий оксид.
Реакция получения оксидов через реакцию с кислородом может осуществляться как при нормальных условиях, так и при повышенной температуре или давлении. Например, реакция металла с кислородом может происходить при обычной температуре воздуха или при нагревании металла в присутствии кислорода.
Примером реакции получения оксидов через реакцию с кислородом может служить образование оксида железа. При нагревании металлического железа в присутствии кислорода происходит образование оксида железа (III) Fe2O3 (ржавчины). Эта реакция является типичным примером получения оксидов металлов путем их окисления кислородом.
Примеры окисления металлов в природных условиях

В природных условиях многие металлы подвергаются окислению, что приводит к образованию различных оксидов. Окисление металлов происходит при взаимодействии с окислительным веществом, например, с кислородом воздуха или водой. Реакция окисления может происходить как под влиянием атмосферных условий, так и при контакте с влажными почвами или водными средами.
Один из наиболее известных примеров окисления металлов в природных условиях – ржавление железа. При столкновении железа с кислородом происходит окисление металла, что приводит к образованию оксида железа (Fe2O3), известного как ржавчина. Ржавление железа является не только косметическим дефектом, но и может приводить к разрушению металлических конструкций.
Еще один пример окисления металлов в природных условиях – окисление алюминия. Алюминий обладает высокой реакционной способностью и быстро окисляется на воздухе. При этом образуется оксид алюминия (Al2O3), который образует защитную пленку на поверхности металла и предотвращает дальнейшее окисление. Эта пленка делает алюминий устойчивым к ржавлению и является одной из причин, почему алюминий широко применяется в строительстве и производстве авиационной и автомобильной техники.
Еще одним интересным примером является окисление меди. Медь при длительном контакте с воздухом и влажностью покрывается темно-зеленой пленкой, которую образует оксид меди (CuO). Эта пленка называется патиной и часто используется для декоративных целей, так как придает металлу особенный эстетический вид.
Вопрос-ответ

Какие вещества могут превращаться в оксиды металла?
Оксиды металла могут образовываться из различных веществ, включая металлы, металлические сплавы, оксиды неметаллов и их соединения.
Какую роль играют оксиды металлов в химических реакциях?
Оксиды металлов играют важную роль в химических реакциях. Они могут быть окислителями или восстановителями, а также сами могут подвергаться окислению или восстановлению. Они могут также служить катализаторами в различных процессах.
Какие принципы лежат в основе реакции получения оксидов металла?
Реакция получения оксидов металла может проходить различными путями, включая нагревание металла в присутствии кислорода, соединение металлического сплава с кислородом или окисление неметалла металлом.
Приведите примеры реакций получения оксидов металла.
Один из примеров реакции получения оксидов металла - образование оксида железа (Fe2O3) в результате нагревания железа (Fe) в присутствии кислорода. Другой пример - образование оксида алюминия (Al2O3) при нагревании алюминия (Al) в присутствии кислорода.
