В химии 9 класса учебником Габриеляна занимается с пятого класса. На этом этапе ученики изучают свойства щелочных металлов, таких как литий, натрий, калий, рубидий и цезий.
Щелочные металлы являются металлами первой группы периодической системы. Они обладают низкой плотностью, низкой плавкостью и высокой химической активностью. Щелочные металлы реагируют с водой, кислородом и другими элементами, образуя соединения с различными свойствами.
Основные свойства щелочных металлов включают мягкость, низкую температуру плавления, высокую электропроводность и способность образовывать соли. Щелочные металлы широко применяются в различных областях, включая производство лекарств, взрывчатых веществ, батарей, стекла и многих других материалов.
Свойства щелочных металлов
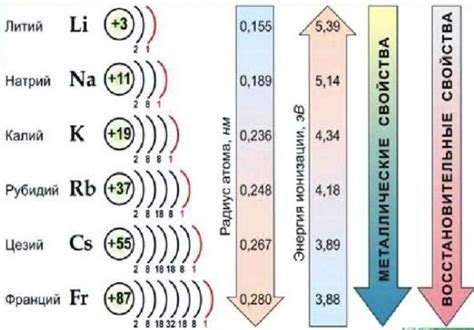
Щелочные металлы - это элементы периодической системы, которые входят в первую группу: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть несколько характерных свойств, которые отличают их от других элементов.
Первое свойство: Щелочные металлы имеют низкую плотность и малую твёрдость. Именно поэтому они мягкие и легко режутся ножом. Например, кусок калия можно разрезать ножом как масло.
Второе свойство: Щелочные металлы очень реактивны. Они быстро окисляются на воздухе, покрываясь оксидной плёнкой. Чтобы предотвратить эту реакцию, щелочные металлы хранят в масле или покрывают защитной плёнкой.
Третье свойство: Щелочные металлы обладают высокой реакционной способностью с водой. При контакте со щелочным металлом вода начинает реагировать и выделяться водород. Эта реакция происходит очень быстро и сопровождается высвобождением большого количества тепла.
Четвертое свойство: Щелочные металлы образуют щелочи. При взаимодействии с водой они образуют гидроксиды, которые обладают выраженными щелочными свойствами. Например, литий реагирует с водой, образуя луговое растворение - гидроксид лития, натрий - гидроксид натрия, и так далее.
Пятое свойство: Щелочные металлы имеют низкую температуру плавления и кипения. Например, рубидий плавится при 39 градусах Цельсия, а кипит при 688 градусах Цельсия.
В целом, свойства щелочных металлов делают их важными и широко используемыми в различных областях, включая промышленность, медицину и технологии.
Получение щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они получаются различными методами.
Одним из способов получения щелочных металлов является электролиз плавящихся солей. Для этого используют специальные электролизеры, в которых нагретая соль переводится в плавящееся состояние. Затем на электроды электролизера подают электрический ток, и в результате на катоде осаждается щелочный металл.
Другим методом получения щелочных металлов является восстановление их соединений с помощью активных металлов. Например, натрий можно получить путем восстановления его оксида алюминием:
- Алюминий реагирует с оксидом натрия по следующему уравнению: 2Al + 3Na2O -> 1Na2O -> 3Na + Al2O3;
- Однако этот метод применяется редко, так как требует больших затрат энергии.
Также щелочные металлы можно получить с помощью реакции металла с водой. Например, реакция натрия с водой обладает высокой энергией и протекает с отделением водорода:
- 2Na + 2H2O -> 2NaOH + H2.
Иногда щелочные металлы получают из руд, содержащих их соединения. Например, из руды полевого шпата (калиевый спат) получают калий. Это происходит путем обжига руды с содой и последующей нейтрализации полученного продукта с помощью кислоты:
| Реакция | Продукт |
|---|---|
| KAlSi3O8 + 8Na2CO3 -> 1Na2CO3 -> 1SiO2 + 1K2CO3 + 4Na2SiO3; | K2CO3 |
| K2CO3 + 2HCl -> 2KCl + H2O + CO2. | KCl |
Реакции щелочных металлов
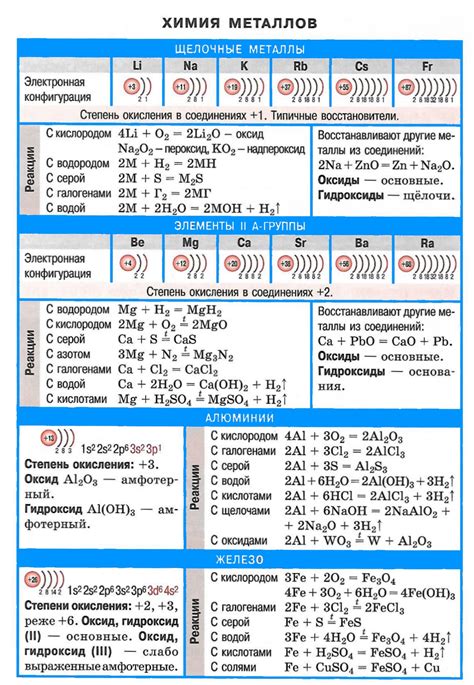
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, относятся к самым активным химическим элементам. Они реагируют с водой, воздухом и большинством неорганических соединений, образуя различные продукты.
Когда щелочный металл взаимодействует с водой, образуется гидроксид этого металла и выделяется водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода газа:
2Na + 2H2O → 2NaOH + H2
Эта реакция происходит достаточно быстро и сопровождается выделением тепла, поэтому взаимодействие щелочных металлов с водой обычно сопровождается факелом и возгоранием водорода.
Щелочные металлы также реагируют с кислородом воздуха, образуя оксиды металлов. Реакция натрия с кислородом происходит при нагревании и приводит к образованию оксида натрия:
4Na + O2 → 2Na2O
Реакции щелочных металлов с неорганическими соединениями также проходят активно. Например, натрий реагирует с хлоридом водорода, образуя хлорид натрия и выделяя водород:
2Na + 2HCl → 2NaCl + H2
В результате реакций щелочных металлов образуются различные химические соединения, которые могут иметь важные применения в промышленности и научных исследованиях.
Применение щелочных металлов
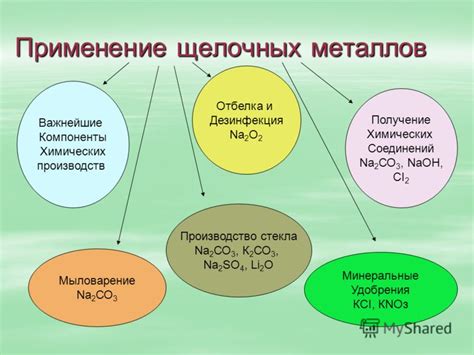
Литий, натрий и калий – это щелочные металлы, которые нашли широкое применение в различных сферах человеческой деятельности.
Литий используется в производстве легких аккумуляторов, которые широко применяются в электронике, мобильных телефонах и электромобилях. Благодаря своим химическим свойствам, литий также применяется в производстве керамики, стекла, лекарственных препаратов и специальных сплавов.
Натрий является одним из основных элементов для производства различных видов соли, таких как поваренная соль, сода и глазировочные соли. Он также используется в производстве стекла, мыла, моющих средств и алюминия. Натрий используется в производстве жидкого аммиака для сельскохозяйственных целей.
Калий применяется в сельском хозяйстве как основной компонент удобрений для повышения плодородия почвы. Он также используется в производстве стекла, мыла и косметических продуктов. Калийные соединения находят применение в промышленности, например, в производстве беспылевых средств для обработки дорог и тротуаров.
Все щелочные металлы обладают высокой реактивностью, что является недостатком при их применении. В связи с этим, щелочные металлы обычно хранят в вакууме или бескислородной среде, чтобы предотвратить их окисление и реакцию с влагой из воздуха.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся элементы первой группы периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какова основная характеристика щелочных металлов?
Основной характеристикой щелочных металлов является их активность, то есть способность вступать в реакции с водой и кислородом.
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают следующими свойствами: низкая плотность, низкая температура плавления и кипения, мягкость, реактивность, способность образовывать соли и щелочи.
Каково значение щелочных металлов в жизни человека?
Щелочные металлы имеют большое значение в жизни человека. Например, натрий и калий являются основными элементами в составе пищи и необходимы для нормального функционирования организма. Литий используется в производстве лекарственных препаратов, а рубидий и цезий применяются в научных исследованиях и технологиях.
Какие металлы являются самыми активными в группе щелочных металлов?
Самыми активными металлами в группе щелочных металлов являются рубидий и цезий. Они обладают высокой реактивностью и могут взрываться при контакте с водой или кислородом.
